早教吧作业答案频道 -->化学-->
氮、硫、碳的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s)⇌N
题目详情
氮、硫、碳的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g) K1△H1<0 (Ⅰ)
2NO(g)+Cl2(g)⇌2ClNO(g) K2△H2<0 (Ⅱ)
4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___(用K1、K2表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡.测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,NO的转化率α1=___.其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2___α1(填“>”“<”或“=”).
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化的情况如图1.
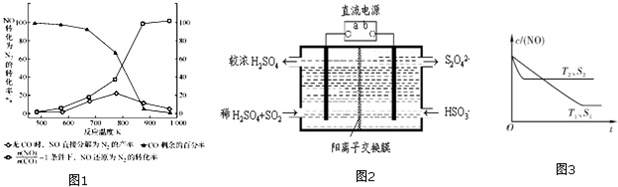
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为___;在
=1的条件下,应控制的最佳温度在___左右.
②NO2尾气常用NaOH溶液吸收,生成NaNO3和 NaNO2.已知NO2-的水解常数K=2×10-11mol•L-1,常温下某NaNO2和 HNO2 混合溶液的PH为5,则混合溶液中c(NO2-)和c(HNO2)的比值为___
(4)利用图2所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2.阳极的电极反应式为___在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO42-生成.该反应的离子方程式为___
(5)消除汽车尾气,可以通过反应2NO(g)+2CO(g)⇌2CO2(g)+N2(g).当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图3表示在其他条件不变时,NO的浓度c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.
①该反应的△H___(填“>”或“<”)0.
②若催化剂的表面积S1>S2,在右图中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注).
(6)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀.查阅资料得知常温下BaSO3的KSP为5.48×10-7,饱和亚硫酸中c(SO32-)=6.3×10-8 mol•L-1. 将0.1mol•L-1的BaCl2溶液滴入饱和亚硫酸中,___ (填“能”或“不能”)生成BaSO3沉淀,原因是___ (请写出必要的推断过程).
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g) K1△H1<0 (Ⅰ)
2NO(g)+Cl2(g)⇌2ClNO(g) K2△H2<0 (Ⅱ)
4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___(用K1、K2表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡.测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,NO的转化率α1=___.其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2___α1(填“>”“<”或“=”).
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化的情况如图1.

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为___;在
| n(NO) |
| n(CO) |
②NO2尾气常用NaOH溶液吸收,生成NaNO3和 NaNO2.已知NO2-的水解常数K=2×10-11mol•L-1,常温下某NaNO2和 HNO2 混合溶液的PH为5,则混合溶液中c(NO2-)和c(HNO2)的比值为___
(4)利用图2所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2.阳极的电极反应式为___在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO42-生成.该反应的离子方程式为___
(5)消除汽车尾气,可以通过反应2NO(g)+2CO(g)⇌2CO2(g)+N2(g).当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图3表示在其他条件不变时,NO的浓度c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.
①该反应的△H___(填“>”或“<”)0.
②若催化剂的表面积S1>S2,在右图中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注).
(6)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀.查阅资料得知常温下BaSO3的KSP为5.48×10-7,饱和亚硫酸中c(SO32-)=6.3×10-8 mol•L-1. 将0.1mol•L-1的BaCl2溶液滴入饱和亚硫酸中,___ (填“能”或“不能”)生成BaSO3沉淀,原因是___ (请写出必要的推断过程).
▼优质解答
答案和解析
(1)已知:①2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g),
②2NO(g)+Cl2(g)⇌2ClNO(g),
根据盖斯定律①×2-②可得:4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=
,
故答案为:
;
(2)测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,由方程式可知参加反应NO物质的量为0.15mol,则NO的转化率为
×100%=75%;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1,
故答案为:75%;>;
(3)①升高温度,发现NO的分解率降低,可能是NO的分解反应是放热反应,升温有利于反应逆向进行,
由图可知,在
=1的条件下,870℃时NO还原为N2的转化率接近为100%,故最佳温度为870℃,
故答案为:NO的分解反应是放热反应,升温有利于反应逆向进行;870℃;
②常温下某NaNO2和 HNO2 混合溶液的PH为5,则溶液中c(OH-)=10-9mol/L,NO2-的水解常数K=
=2×10-11mol•L-1,则混合溶液中c(NO2-)和c(HNO2)的比值为
=50,
故答案为:50;
(4)阳极发生氧化反应,阳极上是二氧化硫被氧化为硫酸根,阳极电极反应式为:SO2+2H2O-2e-=SO42-+4H+;
阴极排出的溶液为S2O42-,与二氧化氮发生转化为无害气体,同时有SO42-生成,无害气体为氮气,反应离子方程式为:4S2O42-+6NO2+8OH-═8SO42-+3N2+4H2O,
故答案为:SO2+2H2O-2e-=SO42-+4H+;4S2O42-+6NO2+8OH-═8SO42-+3N2+4H2O;
(5)①.温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②.催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为: ,故答案为:
,故答案为: ;
;
(6)若溶液中c(Ba2+)=0.1 mol•L-1,c(SO32-)=6.3×10-8mol•L-1,其浓度积Q=c(Ba2+)×c(SO32-)=0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7,故不能析出BaSO3沉淀,
故答案为:不能;若溶液中c(Ba2+)=0.1 mol•L-1,c(SO32-)=6,3×10-8mol•L-1,其浓度积Q=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7.
②2NO(g)+Cl2(g)⇌2ClNO(g),
根据盖斯定律①×2-②可得:4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=
| K12 |
| K2 |
故答案为:
| K12 |
| K2 |
(2)测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,由方程式可知参加反应NO物质的量为0.15mol,则NO的转化率为
| 0.15mol |
| 0.2mol |
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1,
故答案为:75%;>;
(3)①升高温度,发现NO的分解率降低,可能是NO的分解反应是放热反应,升温有利于反应逆向进行,
由图可知,在
| n(NO) |
| n(CO) |
故答案为:NO的分解反应是放热反应,升温有利于反应逆向进行;870℃;
②常温下某NaNO2和 HNO2 混合溶液的PH为5,则溶液中c(OH-)=10-9mol/L,NO2-的水解常数K=
| c(HNO2)×c(OH-) |
| c(NO2-) |
| c(OH-) |
| 2×10-11 |
故答案为:50;
(4)阳极发生氧化反应,阳极上是二氧化硫被氧化为硫酸根,阳极电极反应式为:SO2+2H2O-2e-=SO42-+4H+;
阴极排出的溶液为S2O42-,与二氧化氮发生转化为无害气体,同时有SO42-生成,无害气体为氮气,反应离子方程式为:4S2O42-+6NO2+8OH-═8SO42-+3N2+4H2O,
故答案为:SO2+2H2O-2e-=SO42-+4H+;4S2O42-+6NO2+8OH-═8SO42-+3N2+4H2O;
(5)①.温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②.催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为:
 ,故答案为:
,故答案为: ;
;(6)若溶液中c(Ba2+)=0.1 mol•L-1,c(SO32-)=6.3×10-8mol•L-1,其浓度积Q=c(Ba2+)×c(SO32-)=0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7,故不能析出BaSO3沉淀,
故答案为:不能;若溶液中c(Ba2+)=0.1 mol•L-1,c(SO32-)=6,3×10-8mol•L-1,其浓度积Q=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7.
看了 氮、硫、碳的氧化物有多种,其...的网友还看了以下:
设某算法的计算时间表示为递推关系式T(n)=T(n-1)+n(n>O)及T(0)=1,则该算法的时间 2020-05-26 …
● 设某算法的计算时间表示为递推关系式T(n)= T(n-1) + n (n>0) 及T(0)=1, 2020-05-26 …
关于循环语句的,会的来帮个忙!定义1*2*3*…*N为N的阶乘,记作N!设计一个求N!的算法,并写 2020-06-05 …
下列各项中字音有错误的一项是:()A.永诀(jué)偈子(jié)戳穿(chuō)吮血(shǔn) 2020-06-28 …
证明,若n>=1及x>=0,y>=0,证明不等式(x^n+y^n)>=(x+y)^n 2020-07-21 …
已知等差数列an中,am=n,an=m,(m≠n)求这个数列的第m+n项及a(m+n) 2020-07-23 …
设数列{an}的首项a1=1,前n项和Sn满足关系式:3t*Sn-(2t+3)S(n-1)=3t( 2020-07-30 …
某公司对工作五年及以上的员工施行新的绩效考核制度,现拟定工作业绩W=P+1200,其中P的大小与工作 2020-11-06 …
如图为某男子X,其两任妻子M、N以及四个战乱中走失的孤儿a、b、c、d的DNA样品的指纹图,哪两个孩 2020-11-25 …
明矾具有抗菌、收敛等作用,可作中药及净水剂等,4.74g的明矾晶体[KAl(SO4)2·12H2O] 2020-12-22 …