早教吧作业答案频道 -->化学-->
空气中CO2浓度的持续走高已经引起人们的高度重视,科学家们指出大气中二氧化碳的持续上升不仅会使全球变暖,还会对全球,改变着海水中溶解的无机碳(CO2、HCO3-、CO32-)的浓度与比例.
题目详情
空气中CO2浓度的持续走高已经引起人们的高度重视,科学家们指出大气中二氧化碳的持续上升不仅会使全球变暖,还会对全球,改变着海水中溶解的无机碳(CO2、HCO3-、CO32-)的浓度与比例.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)已知:常温下CO32-反应的平衡常数为2×10-4,海水的pH值约为8,则海水中c(HCO3-):c(CO32-)=___.
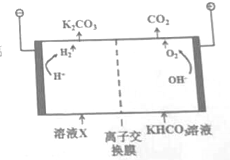
(2)工业上常用高浓度的K2CO3溶液吸收CO2得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如右图:
在阳极发生的反应包括___和H++HCO3-=H2O+CO2↑.该交换膜应用在___离子交换膜(填“阴或阳”);
(3)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇实现碳循环.
已知:在一定条件下
H2(g)+
O2(g)=H2O(g)△H1=-242kJ/mol
CH3OH(g)+
O2(g)=CO2(g)+2H2O(g)△H2=-676kJ/mol
写出该条件下CO2与H2体积之比1:3置于密闭容器中发生以上反应,能说明该反应能达到平衡的是___
A.混合气体的平均相对分子质量不能改变的状态
B.体系中碳元素的百分含量不再变化
C.单位时间内消耗3 molH2,同时生产2 mol C=O
D.CO2和H2的体积比保持不变.

(1)已知:常温下CO32-反应的平衡常数为2×10-4,海水的pH值约为8,则海水中c(HCO3-):c(CO32-)=___.
(2)工业上常用高浓度的K2CO3溶液吸收CO2得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如右图:
在阳极发生的反应包括___和H++HCO3-=H2O+CO2↑.该交换膜应用在___离子交换膜(填“阴或阳”);
(3)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇实现碳循环.
已知:在一定条件下
H2(g)+
| 1 |
| 2 |
CH3OH(g)+
| 3 |
| 2 |
写出该条件下CO2与H2体积之比1:3置于密闭容器中发生以上反应,能说明该反应能达到平衡的是___
A.混合气体的平均相对分子质量不能改变的状态
B.体系中碳元素的百分含量不再变化
C.单位时间内消耗3 molH2,同时生产2 mol C=O
D.CO2和H2的体积比保持不变.
▼优质解答
答案和解析
(1)碳酸钾是强碱弱酸盐,能发生两步水解,第一步水解生成碳酸氢根离子和氢氧根离子,水解方程式为:CO32-+H2O=HCO3-+OH-;ccKh=
,而PH值为8,所以c(OH-)=10-6mol/L,所以c(HCO3-):c(CO32-)=
=2×102,故答案为:2×102;
(2))阳极上氢氧根离子放电生成氧气和水,电极反应式为4OH--4e-═2H2O+O2↑,HCO3-存在电离平衡:HCO3-⇌H++CO32-,阴极H+放电浓度减小平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生,所以碳酸氢根离子可以自由通过,即是阴离子交换膜,
故答案为:4OH--4e-═2H2O+O2↑;阴;
(3)①H2(g)+
O2(g)═H2O(g)△H1=-242kJ/mol①
CH3OH(g)+
O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol②
将方程式3①-②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=3×(-242kJ/mol)-(-676kJ/mol)=-50 kJ/mol,
A.混合气体的平均相对分子质量不能改变的状态,说明各物质的量不变,正逆反应速率相等,故正确;
B.质量守恒知,体系中碳元素的百分含量一直不再,故错误;
C.单位时间内消耗3 molH2,等效于消耗2 mol C=O同时生产2 mol C=O,所以达平衡状态,故正确;
D.CO2和H2的体积比保持不变,因为是1;3投料反应,消耗也是1:3,所以整个过程中两者的体积之比不变,故错误;
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol;AC.
c(HC
| ||
c(C
|
| 2×10-4 |
| 10-6 |
(2))阳极上氢氧根离子放电生成氧气和水,电极反应式为4OH--4e-═2H2O+O2↑,HCO3-存在电离平衡:HCO3-⇌H++CO32-,阴极H+放电浓度减小平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生,所以碳酸氢根离子可以自由通过,即是阴离子交换膜,
故答案为:4OH--4e-═2H2O+O2↑;阴;
(3)①H2(g)+
| 1 |
| 2 |
CH3OH(g)+
| 3 |
| 2 |
将方程式3①-②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=3×(-242kJ/mol)-(-676kJ/mol)=-50 kJ/mol,
A.混合气体的平均相对分子质量不能改变的状态,说明各物质的量不变,正逆反应速率相等,故正确;
B.质量守恒知,体系中碳元素的百分含量一直不再,故错误;
C.单位时间内消耗3 molH2,等效于消耗2 mol C=O同时生产2 mol C=O,所以达平衡状态,故正确;
D.CO2和H2的体积比保持不变,因为是1;3投料反应,消耗也是1:3,所以整个过程中两者的体积之比不变,故错误;
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol;AC.
看了 空气中CO2浓度的持续走高已...的网友还看了以下:
空气中CO2浓度的持续走高已经引起人们的高度重视,科学家们指出大气中二氧化碳的持续上升不仅会使全球 2020-05-16 …
如图,在直角坐标系中,已知点A(-3,0),B(0,4),对△OAB连续作旋转变换,依次得到三角形 2020-05-16 …
如图,在直角坐标系中,已知点A(-3,0),B(0,4),对△OAB连续做旋转变换,依次得到三角形 2020-05-16 …
在平面直角坐标系中,已知抛物线经过点A(0,4)B(1,0)C(5,0)抛物线对称轴与X轴交于M. 2020-05-16 …
●在任务分解中已列出每个工作单元与别的工作单元的关系,据此可梳理出各工作单元之间的依赖关系。 2020-05-26 …
甲在A企业连续工作已满十年,A企业未提出同甲续订劳动合同。因年事已高,甲希望同A企业续订无固定期 2020-05-31 …
列一元二次方程解应用题有四个连续整数,已知它们的和等于其中最大的与最小的两个数的积,求这四个数. 2020-06-27 …
三道七年制的数学题,望达人给予“详细”的解答!已知m-n=3x^2-2x+1N-P=4-2x^2则 2020-07-03 …
中值定理明明已经可导了为什么还要连续可导已经说明了连续啊,说了要可导就不用说连续吗,不是多此一举吗 2020-07-16 …
请各大学士解答解放军进行军事演习,甲、乙两队分别从A、B两地相向而行.甲队以每小时15千米的速度先行 2020-12-18 …