常温下0.1mol•L-1亚硫酸溶液中H2SO3、HSO3-、SO32-三者中所占物质的量分数(α)随pH变化的关系如图所示.下列表述正确的是()A.H2SO3⇌2H++SO32-K=10-5.2B.在0.1mol•LH2SO3溶液中
常温下 0.1mol•L-1 亚硫酸溶液中H2SO3、HSO3-、SO32- 三者中所占物质的量分数(α)随pH 变化的关系如图所示.下列表述 正确的是( )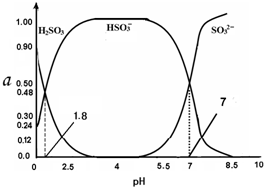
A. H2SO3⇌2H++SO32- K=10-5.2
B. 在0.1mol•L H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw
C. 在pH=2.5 溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
D. 向pH 为 8.5 的上述体系中通入极少量 Cl2 的过程中,溶液中c(HSO3-)和c(SO32-)均减小
| 0.24×1 |
| 0.9 |
B.在0.10 mol•L-1 H2SO3溶液中,根据电荷守恒可得:c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),将电苻守恒式两边都乘c(H+)可得:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+c(H+)•c(OH-),Kw=c(H+)•c(OH-),所以c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw,故B正确;
C.在pH=2.5该溶液中,根据图象曲线可知c(HSO3-)>c(H2SO3),正确的离子浓度大小为:c(HSO3-)>c(H2SO3)>c(H+)>c(OH-),故C错误;
D.溶液的pH=8.5时显碱性,所以c(OH-)>c(H+),根据图象知,溶液中含有的是SO32-,SO32-在溶液中存在水解平衡:SO32-+H2O⇌HSO3-+OH-,向上述体系中通入极少量 Cl2,发生反应为:HSO3-+Cl2+H2O═SO42-+3H++2Cl-,促进SO32-水解,c(SO32-) 减小,而c(HSO3-)增大,故D错误;
故选B.
高一化学13以下怎么读:S^2-,SO3^2-,HS^-,HSO3^-,F^-,MnO4^-,CL 2020-05-15 …
关于沉淀溶解度的计算,在考虑酸效应时有个公式αA(H)=1+β1*〔H+〕+β2*〔H+〕^2在这 2020-06-02 …
请问错在哪里,应如何改正>>v=0.7:1.2;>>h=0.1:0.5;>>[h,v]=meshg 2020-06-11 …
(1)利用I2的氧化性可测定钢铁中硫的含量.做法是将钢样中的硫转化成H2SO3,然后用一定浓度I2 2020-06-20 …
(2013•安徽)已知NaHSO3溶液显酸性,溶液中存在以下平衡:HSO3-+H2O⇌H2SO3+ 2020-07-21 …
氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000m 2020-08-02 …
f(x)=sinx,求f(1+h),[f(1+h)-f(1)]/h根据和差化积公式:sinα-si 2020-08-02 …
数7经过100次“H运算”得到的结果是多少?规定:正整数n的“H运算”:①当n为奇数时,H=3n+1 2020-11-19 …
IO3-与HSO3-在酸性条件下的反应机理如下:①IO3-+HSO3-+H+═HSO4-+H2O2; 2020-11-21 …
已知H2SO3⇌HSO3-+H+,Ka1;HSO3-⇌SO32-+H+,Ka2.常温下,向某浓度的H 2021-01-12 …