早教吧作业答案频道 -->化学-->
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O⇌2NH3+32O2,进一步研究NH3生成量与温度的关系,部分实验数据见表
题目详情
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O⇌2NH3+
O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
请回答下列问题:
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为___ mol•h-1.
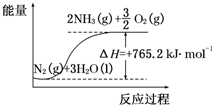
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是___.
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢.请提出可提高其反应速率且增大NH3生成量的建议:___.
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1.在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为___;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量___(填“>”“<”或“=”)92.4kJ.
| 3 |
| 2 |
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |

(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为___ mol•h-1.
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是___.
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢.请提出可提高其反应速率且增大NH3生成量的建议:___.
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1.在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为___;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量___(填“>”“<”或“=”)92.4kJ.
▼优质解答
答案和解析
(1)50℃时从开始到3h内生成氨气为6×10-6mol,则生成氧气为4.5×10-6mol,以O2物质的量变化表示的平均反应速率为
mol•h-1=1.5×10-6mol•h-1,
故答案为:1.5×10-6;
(2)由图可知反应物、生成物及能量变化,反应的热化学方程式是N2(g)+3H2O(l)=2NH3(g)+
O2(g)△H=+765.2kJ•mol-1,
故答案为:N2(g)+3H2O(l)=2NH3(g)+
O2(g)△H=+765.2kJ•mol-1;
(3)由数据可知,温度越高,生成氨气的量越大,则可提高其反应速率且增大NH3生成量的建议为升高温度,故答案为:升高温度;
(4)①某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L,则
N2(g)+3H2(g)⇌2NH3(g)
开始 2 4 0
转化 1 3 2
平衡 1 1 2
K=
=400,
故答案为:400;
②当加入2mol N2和4mol H2时,生成2mol NH3,放出92.4kJ的热量,而当加入a mol N2、b mol H2和c mol NH3时,平衡时NH3仍为2mol,则生成的NH3为(2-c) mol,则放出的热量小于92.4kJ,故答案为:<.
| 4.5×10-6 |
| 3 |
故答案为:1.5×10-6;
(2)由图可知反应物、生成物及能量变化,反应的热化学方程式是N2(g)+3H2O(l)=2NH3(g)+
| 3 |
| 2 |
故答案为:N2(g)+3H2O(l)=2NH3(g)+
| 3 |
| 2 |
(3)由数据可知,温度越高,生成氨气的量越大,则可提高其反应速率且增大NH3生成量的建议为升高温度,故答案为:升高温度;
(4)①某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L,则
N2(g)+3H2(g)⇌2NH3(g)
开始 2 4 0
转化 1 3 2
平衡 1 1 2
K=
(
| ||||
(
|
故答案为:400;
②当加入2mol N2和4mol H2时,生成2mol NH3,放出92.4kJ的热量,而当加入a mol N2、b mol H2和c mol NH3时,平衡时NH3仍为2mol,则生成的NH3为(2-c) mol,则放出的热量小于92.4kJ,故答案为:<.
看了一种“人工固氮”的新方法是在常...的网友还看了以下:
lim(n^3)/(2*n^2+1)-(2*n^2)/(4n-1)n趋向于正无穷lim(n^3)/( 2020-03-30 …
若连续型随机变量X~N(3,4),则(N(0,1)最后是X–3/2还是X–3/若连续型随机变量X~ 2020-04-12 …
计算:1:(-x^n)^2+(x^2)^n-x^n*x^22:[(-n)^2]^5/[(-n*n^ 2020-05-22 …
30分要1已知关于X的二次三项式3X^2+MX+N分解因式结果为(3X+2)(X-1),求M,N的 2020-06-04 …
已知两个等比数列倒序相乘得一新数列,求新数列的前n项和如:求Tn=2∧1×3∧(n-2)+2∧2× 2020-06-08 …
组合数题目求解下面这个式子:C(n-1,2)+2×C(n-2,2)+3×C(n-3,2)+……+( 2020-07-22 …
已知n边形的对角线共有n(n-3)2条(n是不小于3的整数);(1)五边形的对角线共有条;(2)若 2020-07-25 …
为什么真数大于0所以m-2>0,n-1>0则√[(m-2)(n-1)]≤[(m-2)+(n-1)] 2020-07-30 …
若α为第一象限角,则α/3为第几象限角?这个问题我首先是这样解的:α∈(2πk,2πk+π/2)可 2020-08-03 …
n阶行列式第一行1,2,3...n第二行2,3,4...1第三行3,4,5...2中间省略很多行,最 2020-11-01 …