早教吧作业答案频道 -->化学-->
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.(1)SO2和O2反应制取SO3的反应原理为:2SO2+O2催化剂
题目详情
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
(1)SO2和O2反应制取SO3的反应原理为:2SO2+O2
2SO3,在一密闭容器中一定时间内达到平衡.
①该反应的平衡常数表达式为:___.
②该反应达到平衡状态的标志是___.
A.v(SO2)═v(SO3)B.混合物的平均相对分子质量不变 C.混合气体质量不变 D.各组分的体积分数不变
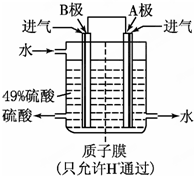
(2)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.
①B电极的电极反应式为___;
②溶液中H+的移动方向由___极到___极;电池总反应式为___.
(3)测定绿矾产品中含量的实验步骤:
a.称取5.7g产品,溶解,配成250mL溶液
b.量取25mL待测液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
□Fe2++□MnO
+□___--□Fe3++□Mn2++□___
②计算上述产品中FeSO4•7H2O的质量分数为___.(原子量:Fe----56 O----16 S---32 H---1)

(1)SO2和O2反应制取SO3的反应原理为:2SO2+O2
| 催化剂 |
| |
| △ |
①该反应的平衡常数表达式为:___.
②该反应达到平衡状态的标志是___.
A.v(SO2)═v(SO3)B.混合物的平均相对分子质量不变 C.混合气体质量不变 D.各组分的体积分数不变
(2)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.
①B电极的电极反应式为___;
②溶液中H+的移动方向由___极到___极;电池总反应式为___.
(3)测定绿矾产品中含量的实验步骤:
a.称取5.7g产品,溶解,配成250mL溶液
b.量取25mL待测液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
□Fe2++□MnO
| - 4 |
②计算上述产品中FeSO4•7H2O的质量分数为___.(原子量:Fe----56 O----16 S---32 H---1)
▼优质解答
答案和解析
(1)①根据反应方程式2SO2+O2⇌2SO3,平衡常数K=
,
故答案为:
;
②A.v(SO2)=v(SO3),没有告诉正逆反应,无法判断正逆反应速率是否相等,故A错误;
B.反应方程式两边都是气体,气体的化学计量数之和不相等,气体的平均相对分子量是个变化的量,混合物的平均相对分子质量不变,说明正逆反应速率相等,达到了平衡状态,故B正确;
C.反应方程式两边都是气体,气体的质量始终不变,所以混合气体质量不变,不能判断是否达到平衡状态,故C错误;
D、各组分的体积分数不变,正逆反应速率相等,说明达到了平衡状态,故D正确;
故选:BD;
(2)①该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,正极上投放的气体是氧气,正极上氧气得电子和氢离子反应生成水,根据硫酸和水的出口方向知,B极是负极,A极是正极,所以B极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
②原电池放电时,氢离子由负极B移向正极A,电池总反应式为:2SO2+O2+2H2O═2H2SO4,
故答案为:B;A;2SO2+O2+2H2O═2H2SO4;
(3)①用硫酸酸化的0.01mol/L KMnO4溶液,所以反应物中一定有氢离子,高锰酸根离子化合价由+7变为+2,降低了5价,亚铁离子与+2变为+3,升高了1价,所以高锰酸根离子系数为1、亚铁离子系数为5,根据电荷守恒、质量守恒配平氢离子、水,配平后的方程式为:5Fe2++1MnO4-+8H+═5Fe3++1Mn2++4H2O,
故答案为:5;1;8;H+;5;1;4;H2O;
②当亚铁离子与高锰酸钾离子完全反应后,再滴入一滴高锰酸钾溶液,溶液会呈淡紫色,据此判断滴定终点,
故答案为:滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色;
③25mL待测液消耗的高锰酸钾的物质的量为:0.01mol/L×0.04L=0.0004mol,
5.7g产品配成250mL溶液消耗高锰酸钾的物质的量为0.0004mol×
=0.004mol,
根据反应:5Fe2++1MnO4-+8H+═5Fe3++Mn2++4H2O,硫酸亚铁的物质的量为:0.004mol×5=0.02mol,
所以样品中含有的FeSO4•7H2O的质量为:278g/mol×0.02mol=5.56g,
FeSO4•7H2O的质量分数为:
×100%≈97.5%,
故答案为:0.975或97.5%.
| c2(SO3) |
| c2(SO2)c(O2) |
故答案为:
| c2(SO3) |
| c2(SO2)c(O2) |
②A.v(SO2)=v(SO3),没有告诉正逆反应,无法判断正逆反应速率是否相等,故A错误;
B.反应方程式两边都是气体,气体的化学计量数之和不相等,气体的平均相对分子量是个变化的量,混合物的平均相对分子质量不变,说明正逆反应速率相等,达到了平衡状态,故B正确;
C.反应方程式两边都是气体,气体的质量始终不变,所以混合气体质量不变,不能判断是否达到平衡状态,故C错误;
D、各组分的体积分数不变,正逆反应速率相等,说明达到了平衡状态,故D正确;
故选:BD;
(2)①该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,正极上投放的气体是氧气,正极上氧气得电子和氢离子反应生成水,根据硫酸和水的出口方向知,B极是负极,A极是正极,所以B极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
②原电池放电时,氢离子由负极B移向正极A,电池总反应式为:2SO2+O2+2H2O═2H2SO4,
故答案为:B;A;2SO2+O2+2H2O═2H2SO4;
(3)①用硫酸酸化的0.01mol/L KMnO4溶液,所以反应物中一定有氢离子,高锰酸根离子化合价由+7变为+2,降低了5价,亚铁离子与+2变为+3,升高了1价,所以高锰酸根离子系数为1、亚铁离子系数为5,根据电荷守恒、质量守恒配平氢离子、水,配平后的方程式为:5Fe2++1MnO4-+8H+═5Fe3++1Mn2++4H2O,
故答案为:5;1;8;H+;5;1;4;H2O;
②当亚铁离子与高锰酸钾离子完全反应后,再滴入一滴高锰酸钾溶液,溶液会呈淡紫色,据此判断滴定终点,
故答案为:滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色;
③25mL待测液消耗的高锰酸钾的物质的量为:0.01mol/L×0.04L=0.0004mol,
5.7g产品配成250mL溶液消耗高锰酸钾的物质的量为0.0004mol×
| 250 |
| 25 |
根据反应:5Fe2++1MnO4-+8H+═5Fe3++Mn2++4H2O,硫酸亚铁的物质的量为:0.004mol×5=0.02mol,
所以样品中含有的FeSO4•7H2O的质量为:278g/mol×0.02mol=5.56g,
FeSO4•7H2O的质量分数为:
| 5,56g |
| 5.7g |
故答案为:0.975或97.5%.
看了硫酸厂用煅烧黄铁矿(FeS2)...的网友还看了以下:
小平在踢毽比赛中踢了42下,他踢的数量是小云的3/4.小云踢了多少下?一种树苗实验成活率是9小平在 2020-04-27 …
1.小孔成像的原理是什么2.照相机的原理是什么3.研究实验平面镜成像实验中为什么拿平板玻璃代替平面 2020-05-14 …
请教这个句子在语法上如何分析Iamwritingthislettertothankyouforth 2020-06-10 …
在下列蜡烛燃烧的实验中,对有关实验现象和要点的描述错误的是()A.实验1中蜡烛火焰逐渐变小直至熄灭 2020-07-06 …
由俄罗斯组织的“火星-500”试验,是人类首次模拟火星载人航天飞行试验.该试验已于2010年6月3 2020-07-12 …
一道语文题(急)1.原因是由于.2.原因时.造成的3.是由于.造成的4.原因是由于.造成的这四句话 2020-07-20 …
某实验小组开展了如图有关碱性的化学性质探究活动.(1)实验1的目的是.(2)使用白色点滴板完成实验 2020-07-21 …
某人进行一项试验若试验成功则停止试验若试验失败再重新试验一次;若试验3次均失败则放弃试验若此人每次 2020-07-22 …
观察图示中植物叶芽结构的纵切面图,回答下列问题.(1)请写出图中的结构名称和作用.[1]是,将来发 2020-07-31 …
下面是六(1)班刘乐乐同学六年级第一学期数学成绩统计表.项目平时测验期末考试学期成绩测验1测验2测验 2020-12-07 …