磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)均是实验室常见试剂。已知:SO2Cl2(g)SO2(g)+Cl2(g)K1△H=akJ/mol(Ⅰ)SO₂(g)+Cl₂(g)+SCl
磺酰氯( SO2Cl2 )和亚硫酰氯( SOCl2 )均是实验室常见试剂。
已知: SO2Cl2(g)![]() SO2(g) + Cl2(g) K1 △ H=a kJ/mol ( Ⅰ )
SO2(g) + Cl2(g) K1 △ H=a kJ/mol ( Ⅰ )
SO ₂ (g) +Cl ₂ (g)+ SCl ₂ (g)![]() 2SOCl ₂ (g) K2 △ H=b kJ/mol (Ⅱ)
2SOCl ₂ (g) K2 △ H=b kJ/mol (Ⅱ)
( 1 )反应: SO2Cl2(g)+ SCl ₂ (g) ![]() 2SOCl2(g) 的平衡常数 K = (用 K1 、 K2 表示),该反应
2SOCl2(g) 的平衡常数 K = (用 K1 、 K2 表示),该反应
△ H= kJ/mol (用 a 、 b 表示)。
( 2 )为研究不同条件对反应(Ⅰ)的影响,以 13.5 g SO2Cl2 充入 2.0L 的烧瓶中,在 101kPa 375K 时 10min 达到平衡,平衡时 SO2Cl2 转化率为 0.80 ,则 0 ~ 10minCl2 的平衡反应速率为 ,平衡时容器内压强为 kPa ,该温度的平衡常数为 ;若要减小 SO2Cl2 转化率,除改变温度外,还可采取的措施是 (列举一种)。
( 3 )磺酰氯对眼和上呼吸道粘膜有强烈的刺激性,发生泄漏时,实验室可用足量 NaOH 固体吸收,发生反应的化学方程式为 ;亚硫酰氯溶于水的离子方程式为 。
( 4 )一定量的 Cl2 用稀 NaOH 溶液吸收,若恰好反应,则溶液中各离子浓度由大到小的顺序为 ;
已知常温时次氯酸的 Ka=2.5 × 10 - 8 则该温度下 NaClO 水解反应的平衡常数
Kb= mol·L - 1
( 1 ) K1 · K2 ; a+b
( 2 ) 0.004mol·L - 1 · min - 1 ; 181.8kPa ; 0.16mol·L - 1 ;增大压强(或缩小容器体积)
( 3 ) SO2Cl2+4NaOH = Na2SO4 + 2NaCl + 2H2O ; SOCl2 + H2O = SO2 ↑ + 2H++2Cl -
( 4 ) c(Na+) > c(Cl - ) > c(ClO - ) > c(OH - ) > c(H+) ; 4 × 10 - 7
【解析】( 1 ) SO2Cl2(g)+ SCl ₂ (g) ![]() 2SOCl2(g) 是由 ( Ⅰ ) 、(Ⅱ)相加得到,故平衡常数为两之积,反应热为两者之和。
2SOCl2(g) 是由 ( Ⅰ ) 、(Ⅱ)相加得到,故平衡常数为两之积,反应热为两者之和。
( 2 )生成 Cl2 的物质的量为 0.08mol 其浓度为 0.04mol ,故速率为 0.004mol·L - 1 · min - 1 ;平衡时总物质的量为: 0.02mol+0.08mol+0.08mol=0.18mol 故平衡时压强为: 0.18mol/0.1mol × 101kPa=181.8kPa ; 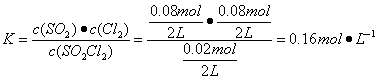 ;若要减小转化率,可通过缩小容器体积即增大加压强的方法,也可起始时再容器中同时充入 SO2Cl2 和 Cl2 或 SO2 。
;若要减小转化率,可通过缩小容器体积即增大加压强的方法,也可起始时再容器中同时充入 SO2Cl2 和 Cl2 或 SO2 。
( 3 ) SO2Cl2 中硫为 +6 价,氯为- 1 ,氢氧化钠足量时生成硫酸盐和盐酸盐; SOCl2 中硫为 +4 价,水解生成 SO2 及 HCl 。( 4 ) Cl2+ 2NaOH = NaCl + NaClO+H2O 显然 c(Na+) 最大,考虑到 ClO -水解显碱性,故 c(Cl - ) > c(ClO - ) , c(OH - ) > c(H+) ; HClO 的电离常数与 ClO -之积等于水的离子积,故 Kb=Kw/Ka=4 × 10 - 7 。
(1)已知:298K、101kpa时,反应Ca0(s)+SO2(g)═CaSO3(g)的△H=-4 2020-05-14 …
电子工业中清冼硅片上的二氧化硅的反应是:SiO2(s)+4HF(g)==SiF4(g)+2H2O( 2020-07-14 …
哪位大哥是学工程热力学的呀,计算1-丁烯蒸气在473.15K,7MPa下的V、U、H和S.解法是: 2020-07-18 …
H2S溶液H和S的比值问题,为什么H和S的比值是大于2的,如果这个大于2,那么醋酸里醋酸根和氢离子 2020-07-20 …
(1)工业清洗硅片上SiO2(s)的反应是:SiO2(s)+4HF(g)═SiF4(g)+2H2O 2020-07-22 …
在测滑轮组机械效率的实验中,对于物体被提升的高度h和弹簧测力计移动的距离s,下列说法中正确的是()A 2020-11-03 …
在“测滑轮组机械功率”的实验中,对于物体被提升的高度h和弹簧测力计移动的距离s,下列说法中正确的是( 2020-11-03 …
在“测滑轮组的机械效率”实验中,对于钩码提升的高度h和弹簧秤移动的距离s,下面说法错误的是()A.h 2020-11-04 …
已知反应2CO(g)=2C(s)+O2(g)的△H为正值,△S为负值,设△H和△S不随温度改变,对于 2020-12-31 …
已知反应2CO(g)═2C(s)+O2(g)的△H为正值,△S为负值.设△H和△S不随温度的改变而改 2020-12-31 …