早教吧作业答案频道 -->化学-->
粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如图:(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有:Pb-2e-+SO42-=PbSO4和.(2
题目详情
粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如图:
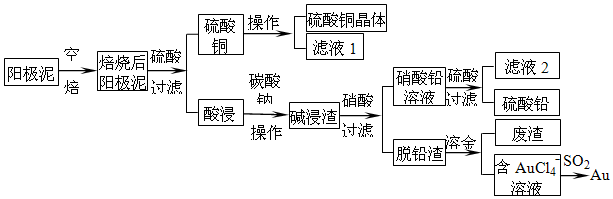
(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有:Pb-2e-+SO42-=PbSO4和___.
(2)碱浸渣的主要成分是___、___.(写化学式)
(3)操作I的主要步骤为___.
(4)写出用SO2还原AuCl4-的离子方程式___.
(5)为了减少废液排放、充分利用有用资源,工业上将滤液2并入硝酸进行循环操作,请指出流程图中另一处类似的做法___.
(6)已知298K时,Ksp(PbCO3)=1.5×10-13,Ksp(PbSO4)=1.8×10-8,将1mol PbSO4固体放入1L Na2CO3溶液中,充分反应后达到平衡,溶液中c(CO32-)为5mol/L,溶液体积在反应前后保持不变,则平衡后c(SO42-)=___.

(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有:Pb-2e-+SO42-=PbSO4和___.
(2)碱浸渣的主要成分是___、___.(写化学式)
(3)操作I的主要步骤为___.
(4)写出用SO2还原AuCl4-的离子方程式___.
(5)为了减少废液排放、充分利用有用资源,工业上将滤液2并入硝酸进行循环操作,请指出流程图中另一处类似的做法___.
(6)已知298K时,Ksp(PbCO3)=1.5×10-13,Ksp(PbSO4)=1.8×10-8,将1mol PbSO4固体放入1L Na2CO3溶液中,充分反应后达到平衡,溶液中c(CO32-)为5mol/L,溶液体积在反应前后保持不变,则平衡后c(SO42-)=___.
▼优质解答
答案和解析
由实验流程可知,粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,焙烧后金属铜成为氧化铜,酸浸可以得到硫酸铜溶液,硫酸铜溶液经过蒸发浓缩,降温结晶,过滤、洗涤,干燥获得硫酸铜晶体;酸浸后的固体中含有Au(金)和PbSO4等杂质经碳酸钠浸洗,硫酸铅转化成碳酸铅,得碱浸渣为Au、PbCO3,浓硝酸氧化后,过滤得到硝酸铅溶液,滤液加硫酸生成硫酸铅沉淀,再过滤得到硫酸铅;脱铅滤渣主要是金,加王水溶金,得到含有AuCl4-的溶液,AuCl4-可以被SO2还原得到Au,
(1)电解精炼的粗铜作阳极会发生氧化反应,其中单质铜和活泼性比Cu强的金属都会发生溶解,因此粗铜中的铜和铅会发生失电子的氧化反应,电极反应式为Cu-2e-=Cu2+、Pb-2e-+SO42-=PbSO4,
故答案为:Cu-2e-=Cu2+;
(2)酸浸后的固体中含有Au(金)和PbSO4等杂质经碳酸钠浸洗,硫酸铅转化成碳酸铅,得碱浸渣为Au、PbCO3,
故答案为:Au、PbCO3;
(3)操作I的步骤是从硫酸铜溶液中获得硫酸铜晶体,因此该步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,故答案为:蒸发浓缩,降温结晶,过滤;
(4)SO2还原AuCl4-中还原剂和氧化剂都比较明确,因此很容易推测出氧化产物是SO42-,还原产物是Au,由氧化还原反应得失电子守恒先缺项配平,然后根据电荷守恒再配平,则得到的反应方程式为2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+,
故答案为:2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+;
(5)滤液1是在结晶硫酸铜时剩下的滤液,还含有少量的未析出的硫酸铜,因此并入前面的硫酸铜溶液进行循环,有利于充分利用,
故答案为:将滤液1并入CuSO4溶液中;
(6)将1mol PbSO4固体放入1L Na2CO3溶液中,溶液中c(SO42-)=1mol/L,根据Ksp(PbCO3)=c(CO32-)×c(Pb2+)=1.5×10-13和c(CO32-)=5 mol/L可知,溶液中的c(Pb2+)=3×10-14mol/L,再根据c(Pb2+)和Ksp(PbSO4)=c(SO42-)×c(Pb2+)可知,饱和溶液中c(SO42-)=
=6×105mol/L>1mol/L,所以溶液中的硫酸根离子没有沉淀,所以c(SO42-)=1mol/L,
故答案为:1mol/L.
(1)电解精炼的粗铜作阳极会发生氧化反应,其中单质铜和活泼性比Cu强的金属都会发生溶解,因此粗铜中的铜和铅会发生失电子的氧化反应,电极反应式为Cu-2e-=Cu2+、Pb-2e-+SO42-=PbSO4,
故答案为:Cu-2e-=Cu2+;
(2)酸浸后的固体中含有Au(金)和PbSO4等杂质经碳酸钠浸洗,硫酸铅转化成碳酸铅,得碱浸渣为Au、PbCO3,
故答案为:Au、PbCO3;
(3)操作I的步骤是从硫酸铜溶液中获得硫酸铜晶体,因此该步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,故答案为:蒸发浓缩,降温结晶,过滤;
(4)SO2还原AuCl4-中还原剂和氧化剂都比较明确,因此很容易推测出氧化产物是SO42-,还原产物是Au,由氧化还原反应得失电子守恒先缺项配平,然后根据电荷守恒再配平,则得到的反应方程式为2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+,
故答案为:2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+;
(5)滤液1是在结晶硫酸铜时剩下的滤液,还含有少量的未析出的硫酸铜,因此并入前面的硫酸铜溶液进行循环,有利于充分利用,
故答案为:将滤液1并入CuSO4溶液中;
(6)将1mol PbSO4固体放入1L Na2CO3溶液中,溶液中c(SO42-)=1mol/L,根据Ksp(PbCO3)=c(CO32-)×c(Pb2+)=1.5×10-13和c(CO32-)=5 mol/L可知,溶液中的c(Pb2+)=3×10-14mol/L,再根据c(Pb2+)和Ksp(PbSO4)=c(SO42-)×c(Pb2+)可知,饱和溶液中c(SO42-)=
| 1.8×10-8 |
| 3×10-14 |
故答案为:1mol/L.
看了粗铜精炼后的阳极泥含有Cu、A...的网友还看了以下:
填空题.(1)在测量水、油等液体的容量时,可以用和作单位.(2)1ttt毫升的水可以注满升的水瓶. 2020-05-15 …
已知直线y=(-3分之根号3)x+1与x轴y轴交与A,B,以AB为边在第一象限内作等边三角形ABC 2020-05-16 …
下列说法正确的是A深度相同的液体产生的压力相等B液体对容器底部的压力等于液体的重力C细管中的水产生 2020-06-04 …
在平面直角坐标系xOy中,点P到定点F(-1,0)的距离的两倍和它到定直线x=-4的距离相等.求P 2020-06-05 …
请用铅笔、图钉自制一只简易密度计,测出家里的食用油、盐水、黄酒、酱油等液体的密度 2020-06-07 …
液体密度计常用来测定啤酒、牛奶等液体的密度,从而判定其中的含水量.如图所示是将一支密度计放入牛奶中 2020-06-16 …
已知A点的坐标为(2,2,2)且与点P的距离等于3,点P的坐标分量都相等,点P的坐标为什么是点的坐 2020-07-21 …
在直角平面坐标内有一点p,p到两坐标轴距离相等,且p到两点a(-1,3),b(2,4)距离相等,求 2020-07-30 …
计量水、油、饮料等液体的多少,通常只用毫升作单位.….(判断对错) 2020-11-28 …
家庭和物理实验常用的温度计,是利用水银、酒精、煤油等液体的性质来测量温度的.为什么不用最常见的水来做 2021-01-22 …