早教吧作业答案频道 -->化学-->
根据要求完成下列问题:(1)某元素原子共有4个价电子,其中2个价电子位于第三能层d轨道,试回答:该元素核外价电子排布图,基态原子核外电子排布式.该元素的原子序数为,该
题目详情
根据要求完成下列问题:
(1)某元素原子共有4个价电子,其中2个价电子位于第三能层d轨道,试回答:该元素核外价电子排布图___,基态原子核外电子排布式___.该元素的原子序数为___,该元素是___元素(填“金属”或“非金属”).
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:___、___、___.
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
(4)在下列物质①PCl3②NH3③CCl4④CO2⑤SO2 ⑥BF3⑦SO3⑧H2O中,属于非极性分子的是(填编号)___.
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H3PO4___H3PO3; HClO4___HClO3; H2SO3___H2SO4.
(6)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为___杂化,VSEPR构型为___,分子的立体构型为___.
②BF3分子中,中心原子的杂化方式为___杂化,分子的立体构型为___.
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于___.
(1)某元素原子共有4个价电子,其中2个价电子位于第三能层d轨道,试回答:该元素核外价电子排布图___,基态原子核外电子排布式___.该元素的原子序数为___,该元素是___元素(填“金属”或“非金属”).
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:___、___、___.
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
(4)在下列物质①PCl3②NH3③CCl4④CO2⑤SO2 ⑥BF3⑦SO3⑧H2O中,属于非极性分子的是(填编号)___.
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H3PO4___H3PO3; HClO4___HClO3; H2SO3___H2SO4.
(6)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为___杂化,VSEPR构型为___,分子的立体构型为___.
②BF3分子中,中心原子的杂化方式为___杂化,分子的立体构型为___.

(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于___.
▼优质解答
答案和解析
(1)某元素原子共有4个价电子,其中2个价电子位于第三能层d轨道,其价电子排布图为: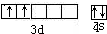 该元素为Ti元素,原子核外有22个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d24s2,该元素位于第四周期第IVB族,为金属元素,
该元素为Ti元素,原子核外有22个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d24s2,该元素位于第四周期第IVB族,为金属元素,
故答案为: ;1s22s22p63s23p63d24s2;22;金属;
;1s22s22p63s23p63d24s2;22;金属;
(2)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,
故答案为:Co3+;CN-;6;
(3)连接4个不同原子或原子团的碳原子为手性碳原子,所以手性碳原子分别为:
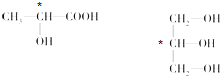 ,故答案为:
,故答案为: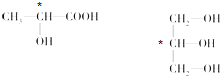 ;
;
(4)①PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,为极性分子;
②NH3中C元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子;
③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
④CO2中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
⑤SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,为极性分子;
⑥BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;
⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,为非极性分子;
⑧H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,为极性分子;
故选:③④⑥⑦;
(5)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强,故酸性:H3PO4>H3PO3,HClO4>HClO3,H2SO32SO4,
故答案为:>;>;<;
(6)①NH3分子中心N原子孤电子对数=
=1,价层电子对数=3+1=4,故N原子采取sp3杂化,VSEPR构型为正四面体,分子的立体构型为三角锥形,
故答案为:sp3;正四面体;三角锥形;
②BF3分子中,B原子孤电子对数=
=0,价层电子对数=3,故B原子采取sp2杂化,分子的立体构型为平面三角形,
故答案为:sp2;平面三角形;
(7)水分子之间存在氢键,沸点高于同族其它元素氢化物,故答案为:水分子之间存在氢键.
 该元素为Ti元素,原子核外有22个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d24s2,该元素位于第四周期第IVB族,为金属元素,
该元素为Ti元素,原子核外有22个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d24s2,该元素位于第四周期第IVB族,为金属元素,故答案为:
 ;1s22s22p63s23p63d24s2;22;金属;
;1s22s22p63s23p63d24s2;22;金属;(2)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,
故答案为:Co3+;CN-;6;
(3)连接4个不同原子或原子团的碳原子为手性碳原子,所以手性碳原子分别为:
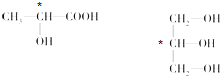 ,故答案为:
,故答案为: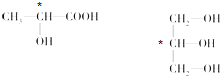 ;
;(4)①PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,为极性分子;
②NH3中C元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子;
③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
④CO2中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
⑤SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,为极性分子;
⑥BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;
⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,为非极性分子;
⑧H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,为极性分子;
故选:③④⑥⑦;
(5)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强,故酸性:H3PO4>H3PO3,HClO4>HClO3,H2SO3
故答案为:>;>;<;
(6)①NH3分子中心N原子孤电子对数=
| 5-1×3 |
| 2 |
故答案为:sp3;正四面体;三角锥形;
②BF3分子中,B原子孤电子对数=
| 3-1×3 |
| 2 |
故答案为:sp2;平面三角形;
(7)水分子之间存在氢键,沸点高于同族其它元素氢化物,故答案为:水分子之间存在氢键.
看了 根据要求完成下列问题:(1)...的网友还看了以下:
(1)求电子在基态轨道上运动时的动能。(2)有一群氢原子处于量子数n=3的激发态。画一能级图,在图 2020-06-08 …
已知氢原子处于基态时,核外电子绕核运动的轨道半径r1=0.53×10-10m,试求:(1)基态时电 2020-07-13 …
求电子在这磁场中的运动轨迹半径一电子的动能为5000eV,进入垂直于它运动方向、磁感应强度为0.0 2020-07-16 …
已知氢原子基态的电子轨道半径为r1=0.528×10-10m,量子数为n的能级值为EN=-13.6 2020-07-17 …
已知氢原子的基态能量为-13.6eV,核外电子的第一轨道半径为0.53×10-10m,电子质量me= 2020-11-11 …
求电子基础知识,电阻电容串并联公式,欧母定律等,一般电子厂面试常用知识. 2020-12-18 …
苯环定位基方面,共轭体系都是追求电子密度的平均化,那么苯环上联有氨基,氮原子含有孤对电子,p-pai 2020-12-25 …
已知氢原子基态的电子轨道半径为r1=0.528×10-10m,量子数为n的能级值为En=-13.6n 2020-12-27 …
原子物理中电子组态和电子基态什么关系怎样从电子组态中分析出自旋角动量轨道角动量G因子,磁矩等量 2020-12-28 …
已知氢原子的电子轨道半径为r1=0.528×10-10m,量子数为n的能级值为。(1)求电子在基态轨 2020-12-28 …