早教吧作业答案频道 -->化学-->
己知A,B、C、D,E五种元素的原子序数依次增大,A元素位于周期表的s区.其原子中电子层数等于未成对电子数:B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子
题目详情
己知A,B、C、D,E五种元素的原子序数依次增大,A元素位于周期表的s区.其原子中电子层数等于未成对电子数:B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3 倍. A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,AB两种元素成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子抹布相同.
(1)E的基态原子的价层电了排布式为___.
(2)下列叙述正确的是___ (填字母)
A.M与水分子能形成氢键,N是非极性分子
B.M和BD2分子中的中心原子均采用sp2杂化
C.N分子中含有6个σ键和3个π键
D.BD2晶体的熔沸点都比二氧化硅晶体的低
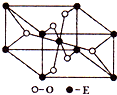
(3)E的一种氧化物Q,其晶胞结构如图所示,则Q的化学式为___,该晶体中氧的配位数为___.
(4)电镀厂排放的废水中常含有剧毒的BC-,可在Q的催化下,先用NaClO将BC氧化成BCD-,再在酸性条件下BCD-继续被NaCIO氧化成C2和BD2.
①与BCD-互为等电子体的分子、离子的化学式依次是___和___(各写1种).
②上述反应中后一步反应的离子方程式是___.
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3▪6H20的绿色晶体,该晶体中两种配位体的物质的量之比为1:5,则该配离子的化学式为___.

(1)E的基态原子的价层电了排布式为___.
(2)下列叙述正确的是___ (填字母)
A.M与水分子能形成氢键,N是非极性分子
B.M和BD2分子中的中心原子均采用sp2杂化
C.N分子中含有6个σ键和3个π键
D.BD2晶体的熔沸点都比二氧化硅晶体的低
(3)E的一种氧化物Q,其晶胞结构如图所示,则Q的化学式为___,该晶体中氧的配位数为___.
(4)电镀厂排放的废水中常含有剧毒的BC-,可在Q的催化下,先用NaClO将BC氧化成BCD-,再在酸性条件下BCD-继续被NaCIO氧化成C2和BD2.
①与BCD-互为等电子体的分子、离子的化学式依次是___和___(各写1种).
②上述反应中后一步反应的离子方程式是___.
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3▪6H20的绿色晶体,该晶体中两种配位体的物质的量之比为1:5,则该配离子的化学式为___.
▼优质解答
答案和解析
A、B、C、D、E五种元素的原子序数依次递增,A位于周期表的s区,其原子中电子层数和未成对电子数相同,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B原子电子排布式为1s22s22p2,故B为碳元素;D原子的核外成对电子数是未成对电子数的3 倍,A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,可推知D为O元素,M为HCHO;C的原子序数介于碳、氧之间,故C为氮元素;A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为苯;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,则E的原子序数为18+4=22,则E为Ti元素.
(1)E为Ti元素,原子核外电子数为22,基态原子的外围电子排布式为:1s22s22p63s23p63d24s2,价电子排布式为3d24s2,
故答案为:3d24s2;
(2)A.HCHO中O氧原子电负性很大,能与与水分子形成氢键,N为苯,是为平面正六边形结构,是非极性分子,故A正确;
B.HCHO中C原子形成3个σ键,没有孤电子对,碳原子采用sp2杂化,二氧化碳分子为直线型结构,碳原子采用sp杂化,故B错误;
C.苯分子中H-C之间是s-sp2形成的σ键,C-C之间是sp2形成的σ键,苯分子中含有12个σ键和1个大π键,故C错误;
D.CO2属于分子晶体,二氧化硅属于原子晶体,二氧化碳的熔点、沸点都比二氧化硅晶体的低,故D正确,
故选:AD;
(3)晶胞中Ti原子数目为1+8×
=2,氧原子数目为2+4×
=4,故氧化物Q的化学式为TiO2,晶胞内部氧原子周围有3个Ti原子,该晶体中氧的配位数为3,
故答案为:TiO2;3;
(4)①CNO-的等电子体的分子、离子的化学式依次为CO2、SCN-等,故答案为:CO2、SCN-等
②CNO-被NaClO氧化成N2和CO2,同时还有为C1-,反应离子方程式为:2CNO-+2H++3ClO-=N2↑+2CO2↑+3C1-+H2O,
故答案为:2CNO-+2H++3ClO-=N2↑+2CO2↑+3C1-+H2O;
(5)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3•6H2O的绿色晶体,该晶体中两配体的物质的量之比为1:5,则配体中有1个Cl-、5个H2O,2个氯离子位于外界,则该配离子的化学式为[TiCl(H2O)5]2+,故答案为:[TiCl(H2O)5]2+.
(1)E为Ti元素,原子核外电子数为22,基态原子的外围电子排布式为:1s22s22p63s23p63d24s2,价电子排布式为3d24s2,
故答案为:3d24s2;
(2)A.HCHO中O氧原子电负性很大,能与与水分子形成氢键,N为苯,是为平面正六边形结构,是非极性分子,故A正确;
B.HCHO中C原子形成3个σ键,没有孤电子对,碳原子采用sp2杂化,二氧化碳分子为直线型结构,碳原子采用sp杂化,故B错误;
C.苯分子中H-C之间是s-sp2形成的σ键,C-C之间是sp2形成的σ键,苯分子中含有12个σ键和1个大π键,故C错误;
D.CO2属于分子晶体,二氧化硅属于原子晶体,二氧化碳的熔点、沸点都比二氧化硅晶体的低,故D正确,
故选:AD;
(3)晶胞中Ti原子数目为1+8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:TiO2;3;
(4)①CNO-的等电子体的分子、离子的化学式依次为CO2、SCN-等,故答案为:CO2、SCN-等
②CNO-被NaClO氧化成N2和CO2,同时还有为C1-,反应离子方程式为:2CNO-+2H++3ClO-=N2↑+2CO2↑+3C1-+H2O,
故答案为:2CNO-+2H++3ClO-=N2↑+2CO2↑+3C1-+H2O;
(5)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3•6H2O的绿色晶体,该晶体中两配体的物质的量之比为1:5,则配体中有1个Cl-、5个H2O,2个氯离子位于外界,则该配离子的化学式为[TiCl(H2O)5]2+,故答案为:[TiCl(H2O)5]2+.
看了己知A,B、C、D,E五种元素...的网友还看了以下:
如图所示,两根相距L平行放置的光滑导电轨道,与水平面的夹角均为α,轨道间有电阻R,处于磁感应强度为 2020-04-27 …
化合物甲中只含有C、H两种元素,化合物乙和丙中都只含有C、H、F三种元素,甲、乙、丙中所有原子的价 2020-06-05 …
已知元素X.Y的原子最外层分别有n个和m-5个电子,次外层分别有n+2个和m个电子,据此推断元素X 2020-06-14 …
在1~20号元素中,原子最外电子层上只有1个或2个电子元素的是:A金属元素B稀有气体元素C非金属元 2020-07-10 …
一对正、负电子可形成一种寿命比较短的称为电子偶素的新粒子.电子偶素中的正电子与负电子都以速率v绕它们 2020-10-30 …
第三主族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素。(1)已知气态氯化铝的化学式为Al2 2020-11-03 …
(2014•江门模拟)如图所示,两根相距L平行放置的光滑导电轨道,与水平面的夹角为θ,轨道间有电阻R 2020-11-12 …
如图所示,有一光滑的水平导电轨道置于竖直向上的匀强磁场中,导轨由两宽度分别为2L、L组合而成.两导体 2020-12-19 …
如图16-4-17所示,水平放置的光滑导电轨道,处在磁感应强度为B=0.5T、方向向上的匀强磁场中, 2020-12-20 …
从结构角度解释石墨为什么能导电根据石墨的构型,碳原子采取SP2杂化后有单电子的两个轨道和其他C成σ键 2021-01-13 …