早教吧作业答案频道 -->化学-->
排放SO2、NO等大气污染物是产生雾霾的因素之一.如何处理和利用SO2、NO是环保科学研究的热点.(1)将物质的量之比为1:1的NO、NO2气体通人冰水中生成HNO2(亚硝酸).某温度T下,0.2mol•L-
题目详情
排放SO2、NO等大气污染物是产生雾霾的因素之一.如何处理和利用SO2、NO是环保科学研究的热点.
(1)将物质的量之比为1:1的NO、NO2气体通人冰水中生成HNO2(亚硝酸).某温度T下,0.2mol•L-1HNO2溶液的pH=2,则该温度下,HNO2的电离常数Ka(HNO2)≈___(保留一位小数).
(2)“脱硝”是指将NO2转化成N2.已知:
①4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H1
②8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H2
③N2(g)+O2(g)═2NO(g)△H3
④2NO(g)+O2(g)═2NO2(g)△H4
△H2=___ (用含△H1、△H3、△H4代数式表示).
(3)利用电解法将雾霾中SO2、NO转化为(NH4)2SO2的装置如图1所示,写出阴极的电极反应式:___.
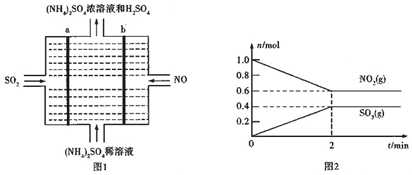
(4)一定温度下,在2L恒容密闭容器中充入等物质的量的NO2和SO2气体反应(产物为两种气体),测得混合气体中NO2、SO3气体的物质的量与时间关系如图2所示.
①下列情况说明该反应达到平衡状态的是___(填字母).
A.混合气体的密度不再改变
B.混合气体的平均相对分子质量不再改变
C.混合气体中NO2体积分数不再改变
D.混合气体的颜色不再改变
②若其他条件不变,达到平衡后,向容器中再充入1mol SO2(g)和1mol NO2(g),平衡___(填“向左”“向右”或“不”)移动,SO2的平衡转化率___(填“增大”“减小”或“不变”).
③上述反应中,在0~2min内SO2的平均反应速率v(SO2)=___.
④在该温度下,该反应的平衡常数K=___(结果保留两位小数).
(1)将物质的量之比为1:1的NO、NO2气体通人冰水中生成HNO2(亚硝酸).某温度T下,0.2mol•L-1HNO2溶液的pH=2,则该温度下,HNO2的电离常数Ka(HNO2)≈___(保留一位小数).
(2)“脱硝”是指将NO2转化成N2.已知:
①4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H1
②8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H2
③N2(g)+O2(g)═2NO(g)△H3
④2NO(g)+O2(g)═2NO2(g)△H4
△H2=___ (用含△H1、△H3、△H4代数式表示).
(3)利用电解法将雾霾中SO2、NO转化为(NH4)2SO2的装置如图1所示,写出阴极的电极反应式:___.

(4)一定温度下,在2L恒容密闭容器中充入等物质的量的NO2和SO2气体反应(产物为两种气体),测得混合气体中NO2、SO3气体的物质的量与时间关系如图2所示.
①下列情况说明该反应达到平衡状态的是___(填字母).
A.混合气体的密度不再改变
B.混合气体的平均相对分子质量不再改变
C.混合气体中NO2体积分数不再改变
D.混合气体的颜色不再改变
②若其他条件不变,达到平衡后,向容器中再充入1mol SO2(g)和1mol NO2(g),平衡___(填“向左”“向右”或“不”)移动,SO2的平衡转化率___(填“增大”“减小”或“不变”).
③上述反应中,在0~2min内SO2的平均反应速率v(SO2)=___.
④在该温度下,该反应的平衡常数K=___(结果保留两位小数).
▼优质解答
答案和解析
(1)Ka(HNO2)=
≈
=
=5.3×10-4,
故答案为:5.3×10-4;
(2)将方程式2①+3③-3④得方程式②,则△H2=2△H1+3△H3-3△H4,
故答案为:2△H1+3△H3-3△H4;
(3)根据图知,电解池中NO得电子和氢离子发生还原反应生成铵根离子,二氧化硫失电子和水反应生成硫酸根离子和氢离子,阴极反应式为NO+5e-+6H+═NH4++H2O,故答案为:NO+5e-+6H+═NH4++H2O;
(4)①A.反应前后气体质量不变、容器体积不变,所以混合气体密度始终不变,不能根据混合气体的密度判断平衡状态,故A错误;
B.反应前后混合气体质量不变、物质的量不变,所以混合气体的平均相对分子质量始终不变,不能据此判断平衡状态,故B错误;
C.混合气体中NO2体积分数不再改变时,正逆反应速率相等,反应达到平衡状态,故C正确;
D.混合气体的颜色不再改变时,正逆反应速率相等,反应达到平衡状态,故D正确;
故选CD;
②相当于缩小体积,增大反应物浓度,压强增大平衡不移动;增大反应物浓度相当于增大压强,该反应前后气体计量数之和不变,压强不影响平衡移动,所以其转化率不变,
故答案为:不;不变;
③上述反应中,在0~2min内SO2的平均反应速率v(SO2)=v(NO2)=
=
mol/(L.min)=0.15mol/(L.min),
故答案为:0.15mol/(L.min);
④该反应 NO2(g)+SO2(g)⇌SO3(g)+NO(g),
开始(mol/L)0.5 0.5 0 0
反应(mol/L)0.2 0.2 0.2 0.2
平衡(mol/L)0.3 0.3 0.2 0.2
化学平衡常数K=
=
,
故答案为:
.
| c(H+).c(NO2-) |
| c(HNO2) |
| c2(H+) |
| c(HNO2) |
| 10-2×10-2 |
| 0.2-10-2 |
故答案为:5.3×10-4;
(2)将方程式2①+3③-3④得方程式②,则△H2=2△H1+3△H3-3△H4,
故答案为:2△H1+3△H3-3△H4;
(3)根据图知,电解池中NO得电子和氢离子发生还原反应生成铵根离子,二氧化硫失电子和水反应生成硫酸根离子和氢离子,阴极反应式为NO+5e-+6H+═NH4++H2O,故答案为:NO+5e-+6H+═NH4++H2O;
(4)①A.反应前后气体质量不变、容器体积不变,所以混合气体密度始终不变,不能根据混合气体的密度判断平衡状态,故A错误;
B.反应前后混合气体质量不变、物质的量不变,所以混合气体的平均相对分子质量始终不变,不能据此判断平衡状态,故B错误;
C.混合气体中NO2体积分数不再改变时,正逆反应速率相等,反应达到平衡状态,故C正确;
D.混合气体的颜色不再改变时,正逆反应速率相等,反应达到平衡状态,故D正确;
故选CD;
②相当于缩小体积,增大反应物浓度,压强增大平衡不移动;增大反应物浓度相当于增大压强,该反应前后气体计量数之和不变,压强不影响平衡移动,所以其转化率不变,
故答案为:不;不变;
③上述反应中,在0~2min内SO2的平均反应速率v(SO2)=v(NO2)=
| ||
| △t |
| ||
| 2 |
故答案为:0.15mol/(L.min);
④该反应 NO2(g)+SO2(g)⇌SO3(g)+NO(g),
开始(mol/L)0.5 0.5 0 0
反应(mol/L)0.2 0.2 0.2 0.2
平衡(mol/L)0.3 0.3 0.2 0.2
化学平衡常数K=
| 0.2×0.2 |
| 0.3×0.3 |
| 4 |
| 9 |
故答案为:
| 4 |
| 9 |
看了排放SO2、NO等大气污染物是...的网友还看了以下:
复式公式怎么算?复利计算公式F=P*(1+i)N(次方)F:复利终值P:本金i:利率N:利率获取时 2020-06-07 …
等额本息算法月还款额=本金*月利率*(1+月利率)^n/[(1+月利率)^n-1]式中:月利率=年 2020-06-10 …
某企业连续n年,每年年初向银行借贷A万元,借款年利率为r,每半年复利计息,则第n年末一次归还贷款额 2020-06-20 …
一次函数y1=kx+b的图像与反比例函数y2=x分之m的图像相交于A、B两点.已知A(-2,1), 2020-06-27 …
小王想用分期付款的方式购买一套价值P万元的商品房.月利率为r,分n月等额还清(按复利计息),小王每 2020-07-23 …
求帮助证明(x^n+y^n)/2>[(x+y)/2]^n其中x>0,y>0,x不等于y,n>1利用 2020-07-29 …
帮忙算算该题,0.01^n*n+0.01^(n-1)*(n-1)+...0.01^1*1(n=36 2020-07-30 …
利用数学归纳法证明:1*2^1/2*3+2*2^2/3*4+3*2^3/4*5+...+利用数学归 2020-08-01 …
已知m+n=1,mn=-1/2,利用因式分解(提公因式法),求m(m+n)(m-n)-m(m+n) 2020-08-03 …
14.已知:1/2—/1/3=(),1/3—1/4=(),1/4—1/5=(),…,1/99—1/1 2020-11-03 …