早教吧作业答案频道 -->化学-->
铁及其化合物在日常生活中有广泛应用.(1)写出Fe与稀H2SO4反应的化学方程式.(2)绿矾(FeSO4•7H2O)是补血剂的原料,易变质,检验是否变质的试剂是.(3)聚合硫酸铁(PFS)是
题目详情
铁及其化合物在日常生活中有广泛应用.
(1)写出Fe与稀H2SO4反应的化学方程式___.
(2)绿矾(FeSO4•7H2O) 是补血剂的原料,易变质,检验是否变质的试剂是___.
(3)聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理,用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe 3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,实验步骤如下: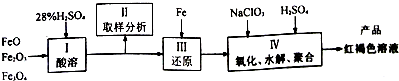
①用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒、玻璃棒外,还有___(选填标号)
a.容量瓶 b.烧杯 c.烧瓶
②Ⅲ中主要反应的离子方程式是___.
③写出Ⅳ中用NaClO3氧化Fe2+时的离子反应方程式___,若改用HNO3氧化,则反应方程式如下:6FeSO4+2HNO3+3H2SO4═3Fe2(SO4)3+2NO↑+4H2O 但缺点是___.
聚合硫酸铁的化学式是[Fe2(OH)n(SO4)3-0.5n]m,运用沉淀法测定聚合硫酸铁产品溶液中Fe3+与SO
物质的量之比.
④需要测定Fe2O3和___的质量(填写化合物的化学式).
⑤测定过程中所需的基本操作除过滤、洗涤外,还有___(选填标号)
a.萃取、分液 b.蒸发、结晶 c.冷却、称量 d.烘干或灼烧.
(1)写出Fe与稀H2SO4反应的化学方程式___.
(2)绿矾(FeSO4•7H2O) 是补血剂的原料,易变质,检验是否变质的试剂是___.
(3)聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理,用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe 3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,实验步骤如下:

①用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒、玻璃棒外,还有___(选填标号)
a.容量瓶 b.烧杯 c.烧瓶
②Ⅲ中主要反应的离子方程式是___.
③写出Ⅳ中用NaClO3氧化Fe2+时的离子反应方程式___,若改用HNO3氧化,则反应方程式如下:6FeSO4+2HNO3+3H2SO4═3Fe2(SO4)3+2NO↑+4H2O 但缺点是___.
聚合硫酸铁的化学式是[Fe2(OH)n(SO4)3-0.5n]m,运用沉淀法测定聚合硫酸铁产品溶液中Fe3+与SO
| 2- 4 |
④需要测定Fe2O3和___的质量(填写化合物的化学式).
⑤测定过程中所需的基本操作除过滤、洗涤外,还有___(选填标号)
a.萃取、分液 b.蒸发、结晶 c.冷却、称量 d.烘干或灼烧.
▼优质解答
答案和解析
(1)Fe与稀H2SO4反应生成硫酸亚铁和氢气,反应方程式为Fe+H2SO4=FeSO4+H2↑,
故答案为:Fe+H2SO4=FeSO4+H2↑;
(2)绿矾(FeSO4•7H2O) 是补血剂的原料,易变质生成三价铁离子,检验是否变质即检验三价铁离子,可以用KSCN溶液,
故答案为:KSCN溶液;
(3)铁的氧化物溶解于硫酸中取样分析溶液中的Fe2+、Fe3+的含量,因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+先被还原为Fe2+;所以确定下一步还原所需铁的量,再被氧化为Fe3+;需要确定氧化Fe2+所需NaClO3的量,通过氧化、水解、聚合得到产品,
①用浓硫酸配稀硫酸的基本步骤是计算、量取、溶解,配制一定量分数硫酸溶液需要的仪器有:胶头滴管、量筒、玻璃棒、烧杯,
故答案为:b;
②Ⅲ中主是用铁将Fe3+还原为Fe2+,反应的离子方程式为Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
③用NaClO3氧化Fe2+时,氯酸根离子被还原成氯离子,亚铁离子被氧化成铁离子,反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,如果用用硝酸氧化,则产物中有一氧化氮,污染空气,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;产生的气体对空气有污染;
④根据测定Fe2O3来测定Fe3+的物质的量,根据测定 BaSO4的质量来测定SO42¯的物质的量考虑,
故答案为:BaSO4;
⑤根据测定沉淀的质量分析基本步骤,从溶液中获得沉淀,要先过滤、洗涤,烘干或灼烧,冷却再称量沉淀质量,根据沉淀质量再进行计算即可,
故选cd.
故答案为:Fe+H2SO4=FeSO4+H2↑;
(2)绿矾(FeSO4•7H2O) 是补血剂的原料,易变质生成三价铁离子,检验是否变质即检验三价铁离子,可以用KSCN溶液,
故答案为:KSCN溶液;
(3)铁的氧化物溶解于硫酸中取样分析溶液中的Fe2+、Fe3+的含量,因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+先被还原为Fe2+;所以确定下一步还原所需铁的量,再被氧化为Fe3+;需要确定氧化Fe2+所需NaClO3的量,通过氧化、水解、聚合得到产品,
①用浓硫酸配稀硫酸的基本步骤是计算、量取、溶解,配制一定量分数硫酸溶液需要的仪器有:胶头滴管、量筒、玻璃棒、烧杯,
故答案为:b;
②Ⅲ中主是用铁将Fe3+还原为Fe2+,反应的离子方程式为Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
③用NaClO3氧化Fe2+时,氯酸根离子被还原成氯离子,亚铁离子被氧化成铁离子,反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,如果用用硝酸氧化,则产物中有一氧化氮,污染空气,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;产生的气体对空气有污染;
④根据测定Fe2O3来测定Fe3+的物质的量,根据测定 BaSO4的质量来测定SO42¯的物质的量考虑,
故答案为:BaSO4;
⑤根据测定沉淀的质量分析基本步骤,从溶液中获得沉淀,要先过滤、洗涤,烘干或灼烧,冷却再称量沉淀质量,根据沉淀质量再进行计算即可,
故选cd.
看了铁及其化合物在日常生活中有广泛...的网友还看了以下:
1、为了鉴定光合作用制造了淀粉,实验室常用的试剂是什么?淀粉遇到该试剂会变成什么颜色?2、写出光合 2020-05-14 …
某有机物A,分子中含两个碳原子,现用A来制取有芳香气味的有机物F和加聚高分子化合物E,其变化如图所 2020-05-14 …
A,B两种物质都是黑色粉末,A,B的混合物在一定条件下发生如下反应:根据如图变化关系和现象,回答下 2020-05-14 …
上面写不下我写在下面,下列方程变形正确的是().①3x+6=0变形为x+2=0②x+7=5-3x变 2020-05-19 …
结合语境,写出同样的词在不同句子中的意思(打正引号反引号的):1.渔夫的脸变得严肃,忧虑.“恩,结 2020-06-27 …
已知集合A={2,4,6,8,9},B={1,2,3,5,8},是否存在集合C,使C中的每一个元素 2020-07-29 …
已知集合A={2,4,6,8,9},B={1,2,3,5,8},是否存在集合C,使C中的每一个元素 2020-07-29 …
用描述法写出以下集合请问应该怎样写呢?1.由4与6的所有公倍数组成的集合2.所有偶数的集合3.方程 2020-08-01 …
A、B、C、D、E分别是铁或铁的化合物,其中D是一种红褐色沉淀,其相互反应关系如图所示:根据如图所示 2020-11-01 …
变一变,写一写学过的拼音字母1.nlianerchaotian脸儿朝天2.bxianghouzhua 2020-12-31 …