早教吧作业答案频道 -->化学-->
ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得.无水草酸100℃可以升华.某学习小组用图1装置模拟工业制取收集ClO2.(1)实验时装置A需在60℃~100℃进
题目详情
ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得.无水草酸100℃可以升华.某学习小组用图1装置模拟工业制取收集ClO2.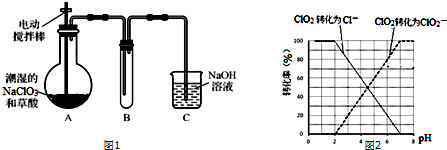
(1)实验时装置A需在60℃~100℃进行的原因是___,控制所需温度的方法是___.
(2)电动搅拌棒的作用是___.装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为___.
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2,写出反应的离子方程式___.
(4)用ClO2处理过的饮用水(pH为5.5~6.5)往往残留少量ClO2和一定量对人体不利的亚氯酸根离子(ClO2-).
①ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图2所示
②当pH≤2.0时,ClO2-也能被I-还原成Cl-
③2Na2S2O3+I2=Na2S4O6+2NaI
根据上述信息,请补充完整测定饮用水中ClO2-含量的实验方案:
取一定体积的饮用水,加入NaOH溶液调节pH为7.0~8.0;___;再重复上述操作1~2次,计算得出结果.
(实验中需使用的试剂:淀粉溶液、标准Na2S2O3溶液、KI溶液、稀硫酸)

(1)实验时装置A需在60℃~100℃进行的原因是___,控制所需温度的方法是___.
(2)电动搅拌棒的作用是___.装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为___.
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2,写出反应的离子方程式___.
(4)用ClO2处理过的饮用水(pH为5.5~6.5)往往残留少量ClO2和一定量对人体不利的亚氯酸根离子(ClO2-).
①ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图2所示
②当pH≤2.0时,ClO2-也能被I-还原成Cl-
③2Na2S2O3+I2=Na2S4O6+2NaI
根据上述信息,请补充完整测定饮用水中ClO2-含量的实验方案:
取一定体积的饮用水,加入NaOH溶液调节pH为7.0~8.0;___;再重复上述操作1~2次,计算得出结果.
(实验中需使用的试剂:淀粉溶液、标准Na2S2O3溶液、KI溶液、稀硫酸)
▼优质解答
答案和解析
(1)一般来说,升高温度,活化分子的百分数增大,反应速率增大,温度过低,化学反应速率较慢,无水草酸100℃可以升华,温度过高草酸升华或分解,所以实验时装置A需在60℃~100℃进行,反应温度低于水的沸点,用水浴可使反应容器受热均匀,所以反应要用水浴加热,
故答案为:温度过低,化学反应速率较慢,温度过高草酸升华或分解;水浴加热;
(2)实验时电动搅拌,能增加反应物的接触机会,将反应物充分混合(或充分反应、或使反应物受热均匀),使反应速率加快,装置A中反应物为NaClO3、H2C2O4,产物有Na2CO3、ClO2和CO2等,Cl(+5→+4),C(+3→+4),根据得失电子守恒和原子守恒,该反应方程式为:2NaClO3+H2C2O4
Na2CO3+CO2↑+2ClO2↑+H2O,
故答案为:将反应物充分混合(或充分反应、或使反应物受热均匀);2NaClO3+H2C2O4
Na2CO3+CO2↑+2ClO2↑+H2O;
(3)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3-,反应的离子方程式为:2ClO2+2OH-=ClO3-+ClO2-+H2O,
故答案为:2ClO2+2OH-=ClO3-+ClO2-+H2O;
(4)信息③用Na2S2O3溶液滴定至终点,说明步骤中有碘生成,是用连续碘量法进行测定,根据曲线图示在pH≤2.0时,ClO2被I-还原只生成Cl-,pH≥7.0时,ClO2被I-还原只生成ClO2-;而用ClO2处理过的饮用水,其pH为5.5~6.5,所以其中既含有ClO2,又含有ClO2-,若将溶液的pH调节为7.0~8.0,则第一阶段滴定时只是ClO2被I-还原只生成ClO2-,溶液的ClO2-没有被I-还原,所以第二阶段滴定前应调节溶液的pH≤2.0,使ClO2-与I-反应,以测定样品水样中亚氯酸根离子的含量,所以需调节溶液的pH≤2.0,所以测定饮用水中ClO2-含量的实验方案为:加入足量KI溶液,加2滴淀粉溶液;用标准Na2S2O3溶液滴定至终点(或蓝色褪去),记录消耗标准Na2S2O3溶液的体积;加入稀硫酸调节溶液的pH≤2.0;继续用标准Na2S2O3溶液滴定至终点,记录消耗标准Na2S2O3溶液的体积,
故答案为:加入足量KI溶液,加2滴淀粉溶液;用标准Na2S2O3溶液滴定至终点(或蓝色褪去),记录消耗标准Na2S2O3溶液的体积;加入稀硫酸调节溶液的pH≤2.0;继续用标准Na2S2O3溶液滴定至终点,记录消耗标准Na2S2O3溶液的体积.
故答案为:温度过低,化学反应速率较慢,温度过高草酸升华或分解;水浴加热;
(2)实验时电动搅拌,能增加反应物的接触机会,将反应物充分混合(或充分反应、或使反应物受热均匀),使反应速率加快,装置A中反应物为NaClO3、H2C2O4,产物有Na2CO3、ClO2和CO2等,Cl(+5→+4),C(+3→+4),根据得失电子守恒和原子守恒,该反应方程式为:2NaClO3+H2C2O4
| ||
故答案为:将反应物充分混合(或充分反应、或使反应物受热均匀);2NaClO3+H2C2O4
| ||
(3)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3-,反应的离子方程式为:2ClO2+2OH-=ClO3-+ClO2-+H2O,
故答案为:2ClO2+2OH-=ClO3-+ClO2-+H2O;
(4)信息③用Na2S2O3溶液滴定至终点,说明步骤中有碘生成,是用连续碘量法进行测定,根据曲线图示在pH≤2.0时,ClO2被I-还原只生成Cl-,pH≥7.0时,ClO2被I-还原只生成ClO2-;而用ClO2处理过的饮用水,其pH为5.5~6.5,所以其中既含有ClO2,又含有ClO2-,若将溶液的pH调节为7.0~8.0,则第一阶段滴定时只是ClO2被I-还原只生成ClO2-,溶液的ClO2-没有被I-还原,所以第二阶段滴定前应调节溶液的pH≤2.0,使ClO2-与I-反应,以测定样品水样中亚氯酸根离子的含量,所以需调节溶液的pH≤2.0,所以测定饮用水中ClO2-含量的实验方案为:加入足量KI溶液,加2滴淀粉溶液;用标准Na2S2O3溶液滴定至终点(或蓝色褪去),记录消耗标准Na2S2O3溶液的体积;加入稀硫酸调节溶液的pH≤2.0;继续用标准Na2S2O3溶液滴定至终点,记录消耗标准Na2S2O3溶液的体积,
故答案为:加入足量KI溶液,加2滴淀粉溶液;用标准Na2S2O3溶液滴定至终点(或蓝色褪去),记录消耗标准Na2S2O3溶液的体积;加入稀硫酸调节溶液的pH≤2.0;继续用标准Na2S2O3溶液滴定至终点,记录消耗标准Na2S2O3溶液的体积.
看了ClO2气体是一种高效、广谱、...的网友还看了以下:
如图所示,一根不能伸长的轻绳一端固定在O点,另一端拴一质量m=0.1kg的小球静止于A点,其右方有 2020-06-17 …
(2010•台州)在如图所示的电路中,电源电压为5伏,L1、L2发光时的电阻均为6欧,小柯应选择两 2020-07-19 …
(2012•利川市二模)如图所示,斜坡OA所在直线的解析式为y=14x,在坡脚O处抛出的小球运行的 2020-07-19 …
如图,在平面直角坐标系中放置一直角三角板,其顶点为A(0,1),B(2,0),O(0,0),将此三 2020-07-19 …
指数函数1.定义在R上的函数f(x)满足f(x).f(y)=f(x+y),且x大于0时,f(x)大 2020-07-22 …
一小球做匀加速直线运动的位移x与时间t的关系如图所示,抛物线上三个点的坐标分别是O(0,0)、A(1 2020-11-01 …
如图,△OAB的三个顶点坐标分别为O(0,0),A(5,O)B(2,4).(1)求△ABO的面积,( 2020-11-04 …
已知O(0,0),A(2,1),O,A,B,C依逆时针方向构成正方形的四个顶点.(1)求B,C两点的 2020-12-21 …
如图,正方形网格中的每个小正方形的边长都是1,在平面直角坐标系中,已知,△ABO的三个顶点的坐标分别 2020-12-25 …
(本小题10分)抛物线经过点O(0,0),A(4,0),B(2,2).(1)求该抛物线的解析式;(2 2021-01-15 …