早教吧作业答案频道 -->化学-->
综合利用CO2、CO对构建低碳社会有重要意义.(1)Li4SiO4可用于富集得到高浓度CO2.原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO
题目详情
综合利用CO2、CO对构建低碳社会有重要意义.
(1)Li4SiO4可用于富集得到高浓度CO2.原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生,700℃时反应的化学方程式为___.
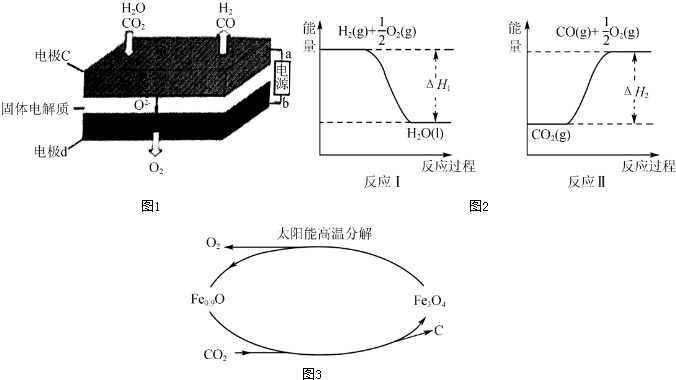
(2)固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图1.
①b为电源的___(填“正极”或“负极”)
②写出电极c发生的电极反应式___、___.
(3)电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g)⇌CH3OH(g),对此进行如下研究:某温度下在一恒压容器中分别冲入1.2molCO和1molH2,达到平衡时容器体积为2L,且含有0.4molCH3OH(g),则该反应平衡常数值为___,此时向容器中再通入0.35molCO气体,则此平衡将___移动(填“向正反应方向”、“不”或“逆反应方向”.)
(4)已知(如图2):若甲醇的燃烧热为△H3,试用△H1、△H3表示CO(g)+2H2(g)⇌CH3OH(l)的△H,△H=___.
(5)利用太阳能和缺铁氧化物[如Fe0.9O]可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图3所示,若用1mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成___molC(碳).
(1)Li4SiO4可用于富集得到高浓度CO2.原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生,700℃时反应的化学方程式为___.
(2)固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图1.
①b为电源的___(填“正极”或“负极”)
②写出电极c发生的电极反应式___、___.
(3)电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g)⇌CH3OH(g),对此进行如下研究:某温度下在一恒压容器中分别冲入1.2molCO和1molH2,达到平衡时容器体积为2L,且含有0.4molCH3OH(g),则该反应平衡常数值为___,此时向容器中再通入0.35molCO气体,则此平衡将___移动(填“向正反应方向”、“不”或“逆反应方向”.)
(4)已知(如图2):若甲醇的燃烧热为△H3,试用△H1、△H3表示CO(g)+2H2(g)⇌CH3OH(l)的△H,△H=___.
(5)利用太阳能和缺铁氧化物[如Fe0.9O]可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图3所示,若用1mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成___molC(碳).

▼优质解答
答案和解析
(1)在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以700℃时反应的化学方程式为:Li2CO3+Li2SiO3
CO2+Li4SiO4,故答案为:Li2CO3+Li2SiO3
CO2+Li4SiO4;
(2)①CO2+H2O
CO+H2+O2,二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气,所以电极d为阳极,所以b为电源的正极,故答案为:正极;
②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,水中的氢元素化合价降低被还原,电极反应式为:H2O
+2e-=H2+O2-,故答案为:CO2+2e-═CO+O2-;H2O+2e-=H2+O2-;
(3)CO(g)+2H2(g)⇌CH3OH(g)
起始:1.2mol 1mol 0
转化:0.4mol 0.8mol 0.4mol
平衡:0.8mol 0.2mol 0.4mol
所以:k=
=50(mol/L)-2,
此时向容器中再通入0.35molCO气体,假设平衡不移动时,此时容器体积为:2L×
=2.5L,则浓度商Qc=
=54.3,大于平衡常数50,平衡向逆反应方向移动,
故答案为:50;逆反应方向;
(4)由图反应Ⅰ可知H2(g)+
O2(g)=H2O(l),△H1;由反应Ⅱ可知:CO2(g)=CO(g)+
O2(g),△H2;若甲醇的燃烧热为△H3,所以CH3OH(g)+
O2(g)=2H2O(l)+CO2(g),△H3;所以盖斯定律,目标反应为:△H=2△H1-△H2-△H3,故答案为::△H=2△H1-△H2-△H3;
(5)依据图示得到化学方程式为:Fe0.9O+0.1CO2=xC+
Fe3O4,
依据碳原子守恒得到x=0.1
故答案为:0.1.
| 700℃ |
| 700℃ |
(2)①CO2+H2O
| 电解 |
| 高温 |
②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,水中的氢元素化合价降低被还原,电极反应式为:H2O
+2e-=H2+O2-,故答案为:CO2+2e-═CO+O2-;H2O+2e-=H2+O2-;
(3)CO(g)+2H2(g)⇌CH3OH(g)
起始:1.2mol 1mol 0
转化:0.4mol 0.8mol 0.4mol
平衡:0.8mol 0.2mol 0.4mol
所以:k=
| 0.2mol/L |
| 0.4mol/L×(0.1mol/L)2 |
此时向容器中再通入0.35molCO气体,假设平衡不移动时,此时容器体积为:2L×
| (0.35+0.8+0.2+0.4)mol |
| (0.8+0.2+0.4)mol |
| ||||
|
故答案为:50;逆反应方向;
(4)由图反应Ⅰ可知H2(g)+
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
(5)依据图示得到化学方程式为:Fe0.9O+0.1CO2=xC+
| 0.9 |
| 3 |
依据碳原子守恒得到x=0.1
故答案为:0.1.
看了综合利用CO2、CO对构建低碳...的网友还看了以下:
以下关于I/O系统的描述中,正确的是( ) A.文件I/O为应用程序提供所需的内存空间B.文件I/O 2020-05-23 …
( 26 )以下关于 I/O 系统的描述中,正确的是A )文件 I/O 为应用程序提供所需的内存空间 2020-05-23 …
(24)下列关于I/O系统的描述中,正确的是( )。A)文件I/O为应用程序提供所需的内存空间B)设 2020-05-23 …
下列关于i/o系统的描述中,正确的是( )。A.文件I/O为应用程序提供所需的内存空间 B.设备I/ 2020-05-23 …
以下关于I/O系统的描述中,正确的是______。A.文件I/O为应用程序提供所需的内存空间B.设备 2020-05-23 …
下面与80×86微处理器I/O有关的叙述中,错误的是A.80×86微处理器有专门的I/O指令,用于对 2020-05-23 …
以下关于I/O系统的描述中,正确的是______。A.文件I/O为应用程序提供所需的内存空间B.文件 2020-05-23 …
下面与80x86微处理器I/O有关的叙述中,错误的是A.80x86微处理器有专门的I/O指令,用于对 2020-05-23 …
下列关于I/O系统的描述中,正确的是()。A.文件I/O为应用程序提供所需的内存空间B.设备I/O通 2020-05-24 …
下面与80x86微处理器I/O有关的叙述中,错误的是( )。A.80x86微处理器有专门的I/O指令 2020-05-24 …