早教吧作业答案频道 -->化学-->
近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:(1)用C
题目详情
近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式:___.
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)⇌4CO2(g)+N2(g)△H=-1200kJ•mol-1
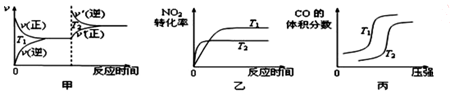
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是___(填代号).
(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)⇌N2(g)+CO2(g)△H=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(NO)=___;计算该反应的平衡常数K=___.
②30min后,只改变某一条件,根据表的数据判断改变的条件可能是___(填字母代号).
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率___(填“升高”或“降低”),a___0(填“>”或“<”).
(4)温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)△H=bkJ/mol.测得有关数据如表:
下列说法正确的是___
A.T1>T2,且b>0
B.当温度为T2、反应进行到40min时,x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50mol CH4(g)、0.50molNO2(g)、1.0mol N2(g)、2.0molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式:___.
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)⇌4CO2(g)+N2(g)△H=-1200kJ•mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是___(填代号).

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)⇌N2(g)+CO2(g)△H=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.3 0 | 0.36 | 0.36 |
②30min后,只改变某一条件,根据表的数据判断改变的条件可能是___(填字母代号).
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率___(填“升高”或“降低”),a___0(填“>”或“<”).
(4)温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)△H=bkJ/mol.测得有关数据如表:
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
A.T1>T2,且b>0
B.当温度为T2、反应进行到40min时,x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50mol CH4(g)、0.50molNO2(g)、1.0mol N2(g)、2.0molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)
▼优质解答
答案和解析
(1)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
由盖斯定律[①+②-③×4]×
可得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ/mol;
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ/mol;
(2)该反应为放热反应,升高温度,正逆反应速率均增大,都应该离开原来的速率点,图象与实际情况不相符,故甲错误;
升高温度,反应向着逆向进行,反应物的转化率减小,反应速率加快,图象与实际反应一致,故乙正确;
压强相同时,升高温度,反应向着逆向移动,一氧化氮的体积分数应该增大,图象与实际不相符,故丙错误;
故答案为:乙;
(3)①T1℃时,该反应在0-20min的平均反应速率v(NO)=
=0.030mol•L-1•min-1;
C(s)+2NO(g)⇌N2(g)+CO2(g),平衡浓度c(N2)=0.3mol/L;c(CO2)=0.3mol/L;c(NO)=0.4mol/L;反应的平衡常数K=
=0.56;
故答案为:0.030mol•L-1•min-1;0.56;
②A.通入一定量的CO2,平衡逆向移动,NO的浓度增大,但是氮气的浓度会减少,与题不符,故A错误;
B.催化剂只改变化学反应速率,不改变化学平衡,故B错误;
C.适当缩小容器的体积,反应前后体积不变,平衡状态物质浓度增大,故C正确;
D.通入一定量的NO,新平衡状态下物质平衡浓度增大,故D正确;
E.加入一定量的活性炭,碳是固体对平衡无影响,平衡不动,故E错误;
故答案为:CD;
③30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比从为2:1:1,氮气和二氧化碳难度之比始终为1:1,所以2:1>4:3,说明平衡向逆反应方向移动,说明平衡向逆反应方向移动,达到新平衡时NO的转化率,说明逆反应是吸热反应,则正反应是放热反应;
故答案为:降低;<;
(4)A、温度升高,反应速率加快,因此T2>T1,甲烷剩余量增多,说明反应向左进行,正反应放热,所以a<0,故A错误;
B、当温度为T2、反应进行到40 min时,反应达到平衡状态,x=0.15,故B错误;
C、温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,平衡逆向移动,重新达到平衡时,n(N2)小于原平衡n(N2)的2倍,故C正确;
D、对于反应 CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)
起始(mol/L) 0.5 1.2 0 0 0
变化(mol/L) 0.4 0.8 0.4 0.4 0.8
平衡(mol/L) 0.1 0.4 0.4 0.4 0.8
温度为T1时,平衡常数K=
=6.4,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50 molH2O(g),浓度商Qc=
=4<K,平衡正向移动,ν(正)>ν(逆),故D正确;
故答案为:CD.
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
由盖斯定律[①+②-③×4]×
| 1 |
| 2 |
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ/mol;
(2)该反应为放热反应,升高温度,正逆反应速率均增大,都应该离开原来的速率点,图象与实际情况不相符,故甲错误;
升高温度,反应向着逆向进行,反应物的转化率减小,反应速率加快,图象与实际反应一致,故乙正确;
压强相同时,升高温度,反应向着逆向移动,一氧化氮的体积分数应该增大,图象与实际不相符,故丙错误;
故答案为:乙;
(3)①T1℃时,该反应在0-20min的平均反应速率v(NO)=
| 1mol/L-0.4mol/L |
| 20min |
C(s)+2NO(g)⇌N2(g)+CO2(g),平衡浓度c(N2)=0.3mol/L;c(CO2)=0.3mol/L;c(NO)=0.4mol/L;反应的平衡常数K=
| 0.3×0.3 |
| 0.42 |
故答案为:0.030mol•L-1•min-1;0.56;
②A.通入一定量的CO2,平衡逆向移动,NO的浓度增大,但是氮气的浓度会减少,与题不符,故A错误;
B.催化剂只改变化学反应速率,不改变化学平衡,故B错误;
C.适当缩小容器的体积,反应前后体积不变,平衡状态物质浓度增大,故C正确;
D.通入一定量的NO,新平衡状态下物质平衡浓度增大,故D正确;
E.加入一定量的活性炭,碳是固体对平衡无影响,平衡不动,故E错误;
故答案为:CD;
③30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比从为2:1:1,氮气和二氧化碳难度之比始终为1:1,所以2:1>4:3,说明平衡向逆反应方向移动,说明平衡向逆反应方向移动,达到新平衡时NO的转化率,说明逆反应是吸热反应,则正反应是放热反应;
故答案为:降低;<;
(4)A、温度升高,反应速率加快,因此T2>T1,甲烷剩余量增多,说明反应向左进行,正反应放热,所以a<0,故A错误;
B、当温度为T2、反应进行到40 min时,反应达到平衡状态,x=0.15,故B错误;
C、温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,平衡逆向移动,重新达到平衡时,n(N2)小于原平衡n(N2)的2倍,故C正确;
D、对于反应 CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)
起始(mol/L) 0.5 1.2 0 0 0
变化(mol/L) 0.4 0.8 0.4 0.4 0.8
平衡(mol/L) 0.1 0.4 0.4 0.4 0.8
温度为T1时,平衡常数K=
| 0.82×0.4×0.4 |
| 0.1×0.42 |
| 0.52×2×1 |
| 0.5×0.52 |
故答案为:CD.
看了近年来“雾霾”污染日益严重,原...的网友还看了以下:
下列说法正确的是()A.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物B.道尔顿、汤姆生、卢瑟 2020-04-08 …
表面积相等的两个圆柱体,体积也一定相等 对还是错 2020-05-16 …
体积相等的两个正方体棱长一定相等对还是错 2020-06-04 …
把3个大小相等的小正方体拼成一个长方体后,表面积减少16平方厘米,这个长方体的体积是[]立方厘米. 2020-06-26 …
1.在除法里,被除数不能是0对还是错2.半径是2厘米的圆周长和面积相等对还是错3.作业量一定,已完 2020-07-17 …
同位角度数相等,对还是错,如果对了,为什么,;错了,又为什么 2020-07-23 …
平行四边形的两组对边分别平行且相等对还是错 2020-07-29 …
如果两个圆锥等底等高,那么这两个圆锥的体积一定相等,对还是错圆锥的体积扩大到原来的3倍,它就等于圆 2020-07-31 …
比值相等的两个比,它们的前项和后项分别相等对还是错还有一题5g的盐溶解在1kg的水中,盐和盐水的质量 2020-11-29 …
判断题,平行线之间的距离处处相等对还是错的注意:没说在同一平面,也没说两条.我想请问,如果是对的,那 2020-12-03 …