早教吧作业答案频道 -->化学-->
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(Ⅰ),氨水]吸收在生产过程中产生的CO和CO2等气体,铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3=[Cu
题目详情
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(Ⅰ),氨水]吸收在生产过程中产生的CO和CO2等气体,铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3=[Cu(NH3)3CO]Ac; 完成下列填空:
①如果要提高上述反应的反应速率,可以采取的措施是___.(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
②铜液中的氨可吸收二氧化碳,写出该反应的化学方程式:___
③简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件).___
④铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___
通过比较___可判断氮、磷两种元素的非金属性强弱.
⑤已知CS2与CO2分子结构相似,CS2的电子式是___CS2熔点高于CO2,其原因是___
⑥提取的NH4Cl中含少量Fe2+、SO42-.将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是___.滤渣的主要成分是___、___.
⑦称取1.840g小苏打样品(含少量NaCl),配置成250mL溶液,取25.00mL用0.1000mol/L盐酸滴定,消耗盐酸21.50mL.实验中所需的定量仪器出滴定管外,还有___.选甲基橙而不选酚酞作为指示剂的原因是___.样品中NaHCO3质量分数为___.(保留3位小数)
⑧将一定量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测量定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果___.(选填“偏高”、“偏低”或“不受影响”)
①如果要提高上述反应的反应速率,可以采取的措施是___.(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
②铜液中的氨可吸收二氧化碳,写出该反应的化学方程式:___
③简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件).___
④铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___
通过比较___可判断氮、磷两种元素的非金属性强弱.
⑤已知CS2与CO2分子结构相似,CS2的电子式是___CS2熔点高于CO2,其原因是___
⑥提取的NH4Cl中含少量Fe2+、SO42-.将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是___.滤渣的主要成分是___、___.
⑦称取1.840g小苏打样品(含少量NaCl),配置成250mL溶液,取25.00mL用0.1000mol/L盐酸滴定,消耗盐酸21.50mL.实验中所需的定量仪器出滴定管外,还有___.选甲基橙而不选酚酞作为指示剂的原因是___.样品中NaHCO3质量分数为___.(保留3位小数)
⑧将一定量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测量定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果___.(选填“偏高”、“偏低”或“不受影响”)
▼优质解答
答案和解析
①增大浓度、升高温度等,可增大反应速率,减压反应速率减小,减小生成物浓度,反应速率减小,故答案为:bc;
②氨气、水、二氧化碳可反应生成碳酸铵或碳酸氢铵,方程式为2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3,
故答案为:2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3;
③正反应放热,铜液吸收CO,应使平衡向正向移动,则可在低温加压下吸收CO,然后将铜洗液转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用,
故答案为:低温加压下吸收CO,然后将铜洗液转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用;
④铜液的组成元素中,短周期元素有H、C、N、O等元素,H原子半径最小,同周期元素从左到右原子半径逐渐减小,则原子半径C>N>O>H,可利用氢化物的稳定性(同条件下硝酸与磷酸的酸性强弱)比较非金属性,故答案为:C>N>O>H;氢化物的稳定性;
⑤CS2的电子式类似于CO2,电子式为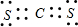 ,二者都为分子晶体,相对分子质量越大,分子间作用力越大,则熔点越高,
,二者都为分子晶体,相对分子质量越大,分子间作用力越大,则熔点越高,
故答案为: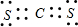 ;二者都为分子晶体,相对分子质量越大,分子间作用力越大.
;二者都为分子晶体,相对分子质量越大,分子间作用力越大.
⑥加热至沸的目的是使亚铁离子快速氧化为三价铁离子,并使氯化铁充分水解,形成氢氧化铁沉淀,滤渣的主要成分是Fe(OH)3(或氢氧化铁)、BaSO4(或硫酸钡),
故答案为:使亚铁离子快速氧化为三价铁离子,并使氯化铁充分水解,形成氢氧化铁沉淀;Fe(OH)3;BaSO4;
⑦配成250mlNaHCO3溶液,用到的仪器有电子天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以所需的定量仪器除滴定管、电子天平外,还有250ml容量瓶;
碳酸氢钠溶液的PH本来就接近8.2,与酚酞变色的PH接近,变色时的PH和反应终点的PH不好判断;而使用甲基橙容易判断终点,且反应产生的二氧化碳不能全部逸出使溶液偏酸性,因此使用甲基橙的误差小;
消耗盐酸的物质的量n(HCl)=0.0215L×0.1000mol/L=0.00215mol,
则25mL溶液中n(NaHCO3)=0.00215mol,
所以样品中m(NaHCO3)=0.00215mol×10×84g/mol=1.806g,
ω(NaHCO3)=
=98.2%=0.982,故答案为:电子天平、250mL容量瓶;使用甲基橙易判断滴定终点,误差小;0.982;
⑧如全部为碳酸氢钠,与盐酸反应后生成氯化钠,质量减小,而如全部为氯化钠时,质量基本不变,可知加热后固体质量越小,碳酸氢钠含量越大,则若蒸发过程中有少量液体溅出,蒸干后所得固体质量偏小,则小苏打含量偏高,故答案为:偏高.
②氨气、水、二氧化碳可反应生成碳酸铵或碳酸氢铵,方程式为2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3,
故答案为:2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3;
③正反应放热,铜液吸收CO,应使平衡向正向移动,则可在低温加压下吸收CO,然后将铜洗液转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用,
故答案为:低温加压下吸收CO,然后将铜洗液转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用;
④铜液的组成元素中,短周期元素有H、C、N、O等元素,H原子半径最小,同周期元素从左到右原子半径逐渐减小,则原子半径C>N>O>H,可利用氢化物的稳定性(同条件下硝酸与磷酸的酸性强弱)比较非金属性,故答案为:C>N>O>H;氢化物的稳定性;
⑤CS2的电子式类似于CO2,电子式为
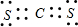 ,二者都为分子晶体,相对分子质量越大,分子间作用力越大,则熔点越高,
,二者都为分子晶体,相对分子质量越大,分子间作用力越大,则熔点越高,故答案为:
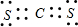 ;二者都为分子晶体,相对分子质量越大,分子间作用力越大.
;二者都为分子晶体,相对分子质量越大,分子间作用力越大.⑥加热至沸的目的是使亚铁离子快速氧化为三价铁离子,并使氯化铁充分水解,形成氢氧化铁沉淀,滤渣的主要成分是Fe(OH)3(或氢氧化铁)、BaSO4(或硫酸钡),
故答案为:使亚铁离子快速氧化为三价铁离子,并使氯化铁充分水解,形成氢氧化铁沉淀;Fe(OH)3;BaSO4;
⑦配成250mlNaHCO3溶液,用到的仪器有电子天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以所需的定量仪器除滴定管、电子天平外,还有250ml容量瓶;
碳酸氢钠溶液的PH本来就接近8.2,与酚酞变色的PH接近,变色时的PH和反应终点的PH不好判断;而使用甲基橙容易判断终点,且反应产生的二氧化碳不能全部逸出使溶液偏酸性,因此使用甲基橙的误差小;
消耗盐酸的物质的量n(HCl)=0.0215L×0.1000mol/L=0.00215mol,
则25mL溶液中n(NaHCO3)=0.00215mol,
所以样品中m(NaHCO3)=0.00215mol×10×84g/mol=1.806g,
ω(NaHCO3)=
| 1.806g |
| 1.840g |
⑧如全部为碳酸氢钠,与盐酸反应后生成氯化钠,质量减小,而如全部为氯化钠时,质量基本不变,可知加热后固体质量越小,碳酸氢钠含量越大,则若蒸发过程中有少量液体溅出,蒸干后所得固体质量偏小,则小苏打含量偏高,故答案为:偏高.
看了合成氨工艺的一个重要工序是铜洗...的网友还看了以下:
下列说法正确的是()A.1mol强酸和1mol强碱完全反应所放出的热量称为中和热B.热化学方程式中 2020-04-08 …
呼吸面具里有Na2O2,可吸收CO2放出O2,若用超氧化钾(KO2)代替过氧化钠,也能吸收CO2生 2020-04-08 …
已知拆开1molH-H键,1molN三N键分别需要吸收的能量为436kJ,946kJ;形成1mol 2020-07-20 …
二氧化碳对地面具有保温作用,是因为能够()A、吸收并放射短波辐射B、吸收短波辐射放射长波辐射C、吸收 2020-11-05 …
化学反应原理这本书中,有条式子△H=H(生成物)-H(反应物)*H是指焓,还有条式子说△H=Q=生成 2020-11-07 …
当反应物与生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热”当吸收或放出热量时温度不是会 2020-11-26 …
(本题共12分)合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产 2020-12-01 …
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(Ⅰ),氨水]吸收在生产过程中产生的CO 2020-12-05 …
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO 2020-12-05 …
化学反应发光的本质是什么?我想既然化学反应吸收或放出热量是化学反应中化学键断裂或结合产生的差值(好象 2021-02-02 …