早教吧作业答案频道 -->化学-->
焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂.某研究小组对焦亚硫酸钠进行如下研究:(1)采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5析出,发生的化学反
题目详情
焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂.某研究小组对焦亚硫酸钠进行如下研究:
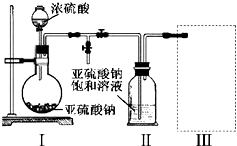
(1)采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.
装置Ⅱ中有Na2S2O5析出,发生的化学反应方程式为:
Na2SO3+SO2=Na2S2O5.
①装置Ⅰ中产生气体的化学方程式为___.
②要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是___.
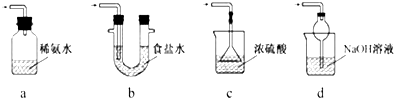
③装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___(填序号).
(2)【查阅资料】Na2S2O5溶于水即生成NaHSO3.
①NaHSO3溶液显酸性.请用化学用语和必要的文字解释原因___;
证明该结论可采用的实验方法是___(填序号).
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
②检验Na2S2O5晶体在空气中已被氧化的实验方案是___.
(3)焦亚硫酸钠(Na2S2O5)在酸性条件下可将工业废水中的Cr2O72-还原为Cr3+.
①写出该反应的离子方程式___.
②若处理Cr2O72-浓度为1×10-3mol/L的工业废水1L,需用Na2S2O5固体___mg.

(1)采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.
装置Ⅱ中有Na2S2O5析出,发生的化学反应方程式为:
Na2SO3+SO2=Na2S2O5.
①装置Ⅰ中产生气体的化学方程式为___.
②要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是___.
③装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___(填序号).

(2)【查阅资料】Na2S2O5溶于水即生成NaHSO3.
①NaHSO3溶液显酸性.请用化学用语和必要的文字解释原因___;
证明该结论可采用的实验方法是___(填序号).
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
②检验Na2S2O5晶体在空气中已被氧化的实验方案是___.
(3)焦亚硫酸钠(Na2S2O5)在酸性条件下可将工业废水中的Cr2O72-还原为Cr3+.
①写出该反应的离子方程式___.
②若处理Cr2O72-浓度为1×10-3mol/L的工业废水1L,需用Na2S2O5固体___mg.
▼优质解答
答案和解析
(1)①由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
②装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离,
故答案为:过滤;
③a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d;
(2)①NaHSO3溶液中HSO3-的电离程度大于水解程度,HSO3-⇌H++SO32-,HSO3-+H20⇌H2SO3+OH-,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性;
故答案为:HSO3-⇌H++SO32-,HSO3-+H20⇌H2SO3+OH-电离程度大于水解程度,所以溶液显酸性;ae;
②Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成;
(3)①焦亚硫酸钠(Na2S2O5)在酸性条件下可将工业废水中的Cr2O72-还原为Cr3+.本身被氧化为硫酸根离子,反应的离子方程式为:2Cr2O72-+3S2O52-+10H+=4Cr3++6SO42-+5H2O或2Cr2O72-+6 HSO3-+10H+=4Cr3++6SO42-+8H2O;
故答案为:2Cr2O72-+3S2O52-+10H+=4Cr3++6SO42-+5H2O或2Cr2O72-+6 HSO3-+10H+=4Cr3++6SO42-+8H2O;
②依据反应定量关系列式计算,处理Cr2O72-浓度为1×10-3mol/L的工业废水1L中Cr2O72-物质的量=1×10-3mol/L×1L=10-3mol;
2Cr2O72-+3S2O52-+10H+=4Cr3++6SO42-+5H2O
2 3
10-3mol 1.5×10-3mol
需用Na2S2O5固体质量=1.5×10-3mol×190g/mol=285×10-3g=285mg,
故答案为:285.
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
②装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离,
故答案为:过滤;
③a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d;
(2)①NaHSO3溶液中HSO3-的电离程度大于水解程度,HSO3-⇌H++SO32-,HSO3-+H20⇌H2SO3+OH-,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性;
故答案为:HSO3-⇌H++SO32-,HSO3-+H20⇌H2SO3+OH-电离程度大于水解程度,所以溶液显酸性;ae;
②Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成;
(3)①焦亚硫酸钠(Na2S2O5)在酸性条件下可将工业废水中的Cr2O72-还原为Cr3+.本身被氧化为硫酸根离子,反应的离子方程式为:2Cr2O72-+3S2O52-+10H+=4Cr3++6SO42-+5H2O或2Cr2O72-+6 HSO3-+10H+=4Cr3++6SO42-+8H2O;
故答案为:2Cr2O72-+3S2O52-+10H+=4Cr3++6SO42-+5H2O或2Cr2O72-+6 HSO3-+10H+=4Cr3++6SO42-+8H2O;
②依据反应定量关系列式计算,处理Cr2O72-浓度为1×10-3mol/L的工业废水1L中Cr2O72-物质的量=1×10-3mol/L×1L=10-3mol;
2Cr2O72-+3S2O52-+10H+=4Cr3++6SO42-+5H2O
2 3
10-3mol 1.5×10-3mol
需用Na2S2O5固体质量=1.5×10-3mol×190g/mol=285×10-3g=285mg,
故答案为:285.
看了焦亚硫酸钠(Na2S2O5)是...的网友还看了以下:
如图所示,在平行四边形ABCD中,对角线AC,BD交于点O.如图所示,在平行四边形ABCD中,对角 2020-05-16 …
(数学题(角))如图,co平分∠acd,bo平分∠abc,且co与bo交于点o如图,co平分∠ac 2020-06-06 …
为比较相同浓度的FeCl3溶液和CuS04溶液对H2O2分解的催化效果,某研究小组进行了如下探究: 2020-06-10 …
如图所示在等腰三角行ABC中,AB=AC,角BAC=50度,角BAC的平分线与AB的中垂线交于点O 2020-07-09 …
等腰Rt△ABC和⊙O如图放置,已知AB=BC=1,∠ABC=90°,⊙O的半径为1,圆心O与直线 2020-07-21 …
如图1已知在圆O中,点C为劣弧AB的中点,连接AC并延长至D,使CD=CA,连接DB并延长交圆O如 2020-07-31 …
如图①,在三角形ABC中,角ABC、角ACB的平分线相交于点O.如图①,在△ABC中,∠ABC、∠ 2020-08-02 …
某同学在做“研究平抛物体的运动”的实验中,忘记记下小球抛出点的位置O,如图所示,A为物体运动一段时间 2020-11-11 …
(2013衡水中学调研)如图所示,上表面光滑的半圆柱体放在水平面上,小物块从靠近半圆柱体顶点O的A点 2020-11-12 …
那新疆2013中考数学的23题呢?刚刚问的是24题,如图,已知⊙O的半径为4,CD是⊙O的直径,AC 2021-01-22 …