早教吧作业答案频道 -->化学-->
工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅.以下是实验室制备SiCl4的装置示意图.已知:SiCl4熔点为-70.0℃,沸点为57.7℃,且遇
题目详情
工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅.以下是实验室制备SiCl4的装置示意图.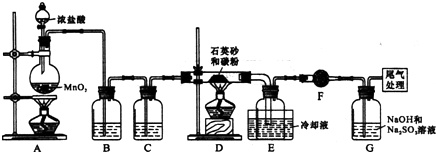
已知:SiCl4熔点为-70.0℃,沸点为57.7℃,且遇水易水解.
(1)装置C中的试剂是___:装置F的作用为___.
(2)装置A中发生反应的离子方程式为:___.A装置中,有一处明显错误是___.
(3)装置D的硬质玻璃管中发生反应的化学方程式是___.
(4)G中吸收气体一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.为探究该吸收液中可能存在的其它酸根离子(忽略空气中CO2的影响).
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-:假设3:只有ClO-.
【设计方案,进行实验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH溶液、溴水、品红溶液、0.01mol/L KMnO4溶液、淀粉-KI溶液.
各取少量吸收液于a、b、c三支试管中,分别滴加适量的3mol/LH2SO4溶液后,进行下列实验.请完成下表:

已知:SiCl4熔点为-70.0℃,沸点为57.7℃,且遇水易水解.
(1)装置C中的试剂是___:装置F的作用为___.
(2)装置A中发生反应的离子方程式为:___.A装置中,有一处明显错误是___.
(3)装置D的硬质玻璃管中发生反应的化学方程式是___.
(4)G中吸收气体一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.为探究该吸收液中可能存在的其它酸根离子(忽略空气中CO2的影响).
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-:假设3:只有ClO-.
【设计方案,进行实验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH溶液、溴水、品红溶液、0.01mol/L KMnO4溶液、淀粉-KI溶液.
各取少量吸收液于a、b、c三支试管中,分别滴加适量的3mol/LH2SO4溶液后,进行下列实验.请完成下表:
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴 ___溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴 ___溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 | ||
| ③ | 向C试管中滴加几滴 ___溶液 | ___ | 假设3成立 |
▼优质解答
答案和解析
(1)浓盐酸具有挥发性,加热促进挥发,导致制取的氯气中含有氯化氢,为除去氯化氢,装置B中的试剂应该吸收氯化氢而不能吸收氯气,为饱和食盐水,装置C用浓硫酸吸水,四氯化硅遇水极易水解,F可防止右端的水蒸气进入E与四氯化硅反应,造成产物不纯,
故答案为:浓硫酸;防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯;
(2)装置A是氯气发生装置,A中二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,其离子方程式为MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑,圆底烧瓶底部表面积比较大,需用石棉网确保底部受热均匀,所以A装置中,有一处明显错误是圆底烧瓶加热缺少石棉网,
故答案为:MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑;无石棉网;
(3)在D装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳,反应为:SiO2+2C+2Cl2
SiCl4+2CO,
故答案为:SiO2+2C+2Cl2
SiCl4+2CO;
(4)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3,
故答案为:①0.01mol/L的KMnO4(或溴水);②品红;③淀粉-KI;若溶液变为蓝色.
故答案为:浓硫酸;防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯;
(2)装置A是氯气发生装置,A中二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,其离子方程式为MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
(3)在D装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳,反应为:SiO2+2C+2Cl2
| ||
故答案为:SiO2+2C+2Cl2
| ||
(4)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3,
故答案为:①0.01mol/L的KMnO4(或溴水);②品红;③淀粉-KI;若溶液变为蓝色.
看了工业上可用焦炭与二氧化硅的混合...的网友还看了以下:
通常标准大气压下,酒精的沸点是78℃,水银的沸点是357℃.你认为要测沸水的温度,应选用(选填“酒 2020-05-14 …
勒夏特列原理的应用.在实际生产中反应2so2+o2=2so3为放热反应,应选用的适宜条件是A.高温 2020-06-05 …
常用的温度有两种计量标准:一种是摄氏温度.中央气象台天气报中的气温,用的就是摄氏温度;另外一中是华 2020-06-10 …
使用温度计测液体温度是什么,应注意温度计不能用来测量超过它的什么的温度;应使用温度计的玻璃泡什么浸 2020-06-22 …
已知1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,甲同学拟在浓硫酸作用下,使1-丁醇和乙酸进 2020-07-18 …
(7996•鄂州)焊接铁轨的反应是:2Al+Fe2她7高温.2Fe+Al2她7,在此反应六,还原剂是 2020-11-12 …
化学反应过程中的温度怎样控制我在进行硫酸铜和铁的置换过程中,加入一定量的浓硫酸,它的反应温度太高达到 2021-01-07 …
如表是几种物质的凝固点和沸点.南极的最低气温是-的88.3℃应选用来测量南极气温.在标准大气压下,沸 2021-02-20 …
几种物质的熔点和沸点如下表所示,当温度为360℃时,铅是态,要测出沸水的温度,应选用温度计,在很冷的 2021-02-21 …
几种物质的熔点和沸点如下表所示,当温度为360℃时,铅是态,要测出沸水的温度,应选用温度计,在很冷的 2021-02-21 …