早教吧作业答案频道 -->化学-->
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)⇌CH3OH
题目详情
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1
②H2O(l)═H2O(g)△H3=44.0kJ•mol-1
请回答(不考虑温度对△H的影响):

(1)反应I的平衡常数表达式K=___;反应II的△H2=___kJ•mol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有___.
A.使用催化剂Cat.1B.使用催化剂Cat.2C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___.
(4)在图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图.
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在___极,该电极反应式是___.
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1
②H2O(l)═H2O(g)△H3=44.0kJ•mol-1
请回答(不考虑温度对△H的影响):

(1)反应I的平衡常数表达式K=___;反应II的△H2=___kJ•mol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有___.
A.使用催化剂Cat.1B.使用催化剂Cat.2C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___.
(4)在图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图.
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在___极,该电极反应式是___.
▼优质解答
答案和解析
(1)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值,该反应的平衡常数为:K=
,
已知:CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1,②H2O(1)═H2O(g)△H3=44.0kJ•mol-1,可知热化学方程式a.CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1,b.H2(g)+
O2(g)=H2O(1)△H=-285.8kJ•mol-1,c.H2O(1)═H2O(g)△H3=44.0kJ•mol-1,
由盖斯定律将b-a+c可得:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2 =(-285.8+283.0+44)kJ•mol-1=+41.2kJ•mol-1,
故答案为:
;+41.2;
(2)A.使用催化剂Cat.1,平衡不移动,不能提高转化率,故A错误;
B、使用催化剂Cat.2,不能提高转化率,故B错误;
C、降低反应温度,平衡正向移动,可增大转化率,故C正确;
D、投料比不变,增加反应物的浓度,衡正向移动,可增大转化率,故D正确;
E、增大 CO2和H2的初始投料比,可增大氢气的转化率,二氧化碳的转化率减小,故E错误.
故答案为:CD;
(3)从表中数据分析,在相同温度下,不同的催化剂二氧化碳的转化率不同,说明不同的催化剂的催化能力不同,相同的催化剂不同的温度,二氧化碳的转化率不同,且温度高的转化率大,因为正反应为放热反应,说明表中数据是未达到平衡数据,
故答案为:表中数据表明此时未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响;
(4)从表中数据分析,在催化剂Cat.2的作用下,甲醇的选择性更大,说明催化剂Cat.2对反应Ⅰ催化效果更好,催化剂能降低反应的活化能,说明使用催化剂Cat.2的反应过程中活化能更低,故图为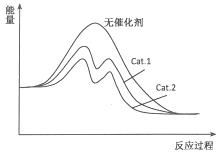 ,
,
故答案为: ;
;
(5)CO2也可在酸性水溶液中通过电解生成甲醇,C元素化合价降低,被还原,应为电解池的阴极反应,电极方程式为:CO2+6H++6e-=CH3OH+H2O,
故答案为:阴;CO2+6H++6e-=CH3OH+H2O.
| c(CH3OH)•c(H2O) |
| c(CO2)•c3(H2) |
已知:CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1,②H2O(1)═H2O(g)△H3=44.0kJ•mol-1,可知热化学方程式a.CO(g)+
| 1 |
| 2 |
| 1 |
| 2 |
由盖斯定律将b-a+c可得:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2 =(-285.8+283.0+44)kJ•mol-1=+41.2kJ•mol-1,
故答案为:
| c(CH3OH)•c(H2O) |
| c(CO2)•c3(H2) |
(2)A.使用催化剂Cat.1,平衡不移动,不能提高转化率,故A错误;
B、使用催化剂Cat.2,不能提高转化率,故B错误;
C、降低反应温度,平衡正向移动,可增大转化率,故C正确;
D、投料比不变,增加反应物的浓度,衡正向移动,可增大转化率,故D正确;
E、增大 CO2和H2的初始投料比,可增大氢气的转化率,二氧化碳的转化率减小,故E错误.
故答案为:CD;
(3)从表中数据分析,在相同温度下,不同的催化剂二氧化碳的转化率不同,说明不同的催化剂的催化能力不同,相同的催化剂不同的温度,二氧化碳的转化率不同,且温度高的转化率大,因为正反应为放热反应,说明表中数据是未达到平衡数据,
故答案为:表中数据表明此时未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响;
(4)从表中数据分析,在催化剂Cat.2的作用下,甲醇的选择性更大,说明催化剂Cat.2对反应Ⅰ催化效果更好,催化剂能降低反应的活化能,说明使用催化剂Cat.2的反应过程中活化能更低,故图为
 ,
,故答案为:
 ;
;(5)CO2也可在酸性水溶液中通过电解生成甲醇,C元素化合价降低,被还原,应为电解池的阴极反应,电极方程式为:CO2+6H++6e-=CH3OH+H2O,
故答案为:阴;CO2+6H++6e-=CH3OH+H2O.
看了催化还原CO2是解决温室效应及...的网友还看了以下:
一辆汽车从A地开往B地,正常行驶的平均速度为64km/h,如平均速度达到72km/h,则可缩短20 2020-05-12 …
下列关于在人体细胞呼吸过程中,[H]的来源于用途的叙述,最准确的是呼吸类型[H]的来源[H]的用途 2020-05-14 …
微积分中导数的定义运用问题1.设f(0)=0,则f(x)在x=0处可导的充分必要条件是:(A)h趋 2020-06-04 …
△ABC为正△PA⊥平面ABCA在平面PBC内摄影为H求证H不可能是△PBC的垂心 2020-06-10 …
请问我家智能电表上峰:764.44KW/h,平:399.52KW/h,谷:913.02,怎么看度数 2020-06-18 …
某高速列车从甲站出发,经过乙、丙站到达丁站,其运行的时刻表如下表所示,列车由甲站驶到乙站的平均速度 2020-07-11 …
从王老师家到学校全程3.3km,其中有一段上坡路、一段平路和一段下坡路,王老师每天步行上下班.如果 2020-07-22 …
有一三棱锥V-ABC,在三角形ABC中,角BAC=75度,线段VA垂直于平面ABC,点A在平面VB 2020-07-30 …
物体自由下落时,下落距离h米可用公式h=5t平方来估计,其中t秒表示物体下落经过的时间.(1)把物体 2020-11-03 …
下面是光合作用和呼吸作用过程中产生[H]的细胞器及[H]的来源和用途的比较,其中正确的是()细胞器来 2021-01-22 …