早教吧作业答案频道 -->化学-->
MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4.一种MnO2制备KMnO4的方法如下:(1)写出“溶化氧化”的化学反应方程式:;(2)从
题目详情
MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4.一种MnO2制备KMnO4的方法如下:
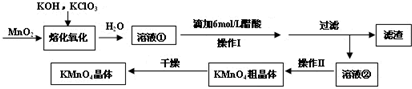
(1)写出“溶化氧化”的化学反应方程式:___;
(2)从溶液②中得到KMnO4粗晶体的方法是___;
(3)上述流程中可以循环使用的物质是___;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的___mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因:
①不采用盐酸的原因:___;
②不采用硫酸的原因:___.
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法:
①在K2MnO4溶液中通入氯气,写出该反应的离子方程式___;
②电解K2MnO4溶液,电解的总反应离子方程式为___.

(1)写出“溶化氧化”的化学反应方程式:___;
(2)从溶液②中得到KMnO4粗晶体的方法是___;
(3)上述流程中可以循环使用的物质是___;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的___mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因:
①不采用盐酸的原因:___;
②不采用硫酸的原因:___.
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法:
①在K2MnO4溶液中通入氯气,写出该反应的离子方程式___;
②电解K2MnO4溶液,电解的总反应离子方程式为___.
▼优质解答
答案和解析
MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,溶于水得到溶液①,K2MnO4溶液经加入稀醋酸酸化后转化为MnO2和KMnO4.过滤得到滤渣为MnO2,滤液为溶液②蒸发浓缩,冷却结晶,过滤,干燥得到KMnO4晶体;
(1)由软锰i随高锰酸钾矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,反应中化合价变化的元素为Mn、Cl,Mn元素由+4价升高为+6,Cl元素化合价由+5降低为-1,根据化合价升降相等,则二氧化锰与氯酸钾的物质的量之比为3:1,再根据原子守恒配平方程式为:3MnO2+6KOH+KClO3
3K2MnO4+KCl+3H2O,
故答案为:3MnO2+6KOH+KClO3
3K2MnO4+KCl+3H2O;
(2)由溶液得到晶体,需要蒸发浓缩,冷却结晶,即步骤③的操作为蒸发浓缩,冷却结晶,过滤洗涤得到KMnO4晶体,
故答案为:蒸发浓缩,冷却结晶;
(3)上述过程中MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,溶于水得到溶液①,K2MnO4溶液经加入稀硫酸酸化后转化为MnO2和KMnO4.过滤得到滤渣为MnO2,循环使用的物质为二氧化锰,
故答案为:MnO2;
(4)(4)3MnO2+KClO3+6KOH
3K2MnO4+KCl+3H2O,K2MnO4转变为MnO2和KMnO4,离子反应为4H++3MnO42-═MnO2+2MnO4-+2H2O,得到定量关系为:
3MnO2~2KMnO4
3 2
1mol
mol
故答案为:
;
(5)①不采用盐酸的原因是盐酸具有还原性,高锰酸钾具有氧化性,二者混合反应生成污染性的气体氯气,
故答案为:盐酸具有还原性,高锰酸钾具有氧化性,反应生成氯气;
②已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,硫酸钾溶解度低,在蒸发浓缩过程中容易析出而造成高锰酸钾产品纯度下降,
故答案为:硫酸钾溶解度低,在蒸发浓缩过程中容易析出而造成高锰酸钾产品纯度下降;
(6)①在K2MnO4溶液中通入氯气,氯气氧化K2MnO4为高锰酸钾,反应的离子方程式为:Cl2+2MnO42-=2MnO4-+2Cl-,
故答案为:Cl2+2MnO42-=2MnO4-+2Cl-;
②电解K2MnO4溶液,阳极是MnO42-失电子发生氧化反应生成MnO4-,阴极是氢离子得到电子生成氢气,结合电荷守恒、原子守恒配平书写电解反应,反应的离子方程式为:2MnO42-+2H2O
2MnO4-+H2↑+2OH-;
故答案为:2MnO42-+2H2O
2MnO4-+H2↑+2OH-.
(1)由软锰i随高锰酸钾矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,反应中化合价变化的元素为Mn、Cl,Mn元素由+4价升高为+6,Cl元素化合价由+5降低为-1,根据化合价升降相等,则二氧化锰与氯酸钾的物质的量之比为3:1,再根据原子守恒配平方程式为:3MnO2+6KOH+KClO3
| ||
故答案为:3MnO2+6KOH+KClO3
| ||
(2)由溶液得到晶体,需要蒸发浓缩,冷却结晶,即步骤③的操作为蒸发浓缩,冷却结晶,过滤洗涤得到KMnO4晶体,
故答案为:蒸发浓缩,冷却结晶;
(3)上述过程中MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,溶于水得到溶液①,K2MnO4溶液经加入稀硫酸酸化后转化为MnO2和KMnO4.过滤得到滤渣为MnO2,循环使用的物质为二氧化锰,
故答案为:MnO2;
(4)(4)3MnO2+KClO3+6KOH
| ||
3MnO2~2KMnO4
3 2
1mol
| 2 |
| 3 |
故答案为:
| 2 |
| 3 |
(5)①不采用盐酸的原因是盐酸具有还原性,高锰酸钾具有氧化性,二者混合反应生成污染性的气体氯气,
故答案为:盐酸具有还原性,高锰酸钾具有氧化性,反应生成氯气;
②已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,硫酸钾溶解度低,在蒸发浓缩过程中容易析出而造成高锰酸钾产品纯度下降,
故答案为:硫酸钾溶解度低,在蒸发浓缩过程中容易析出而造成高锰酸钾产品纯度下降;
(6)①在K2MnO4溶液中通入氯气,氯气氧化K2MnO4为高锰酸钾,反应的离子方程式为:Cl2+2MnO42-=2MnO4-+2Cl-,
故答案为:Cl2+2MnO42-=2MnO4-+2Cl-;
②电解K2MnO4溶液,阳极是MnO42-失电子发生氧化反应生成MnO4-,阴极是氢离子得到电子生成氢气,结合电荷守恒、原子守恒配平书写电解反应,反应的离子方程式为:2MnO42-+2H2O
| ||
故答案为:2MnO42-+2H2O
| ||
看了MnO2与过量固体KOH和KC...的网友还看了以下:
已知是i,m,n正整数,且1 (1+n)^m第一小问的A(i m)和A(i n)是排列公式,上面i 2020-05-16 …
地球上所有生物及其所生活的环境称之为生物圈,生物圈的范围在海平面一下约m和海平面以上约m包括、和. 2020-05-16 …
物体受力的临界问题M,m叠放,M在下面,m和M间的动摩擦因数为μ1,M与地面的动摩擦因数μ2,水平 2020-06-05 …
如图所示,质量分别为m和M的两个星球A和B在万有引力作用下都绕O点做匀速圆周运动,星球A和B两者中 2020-06-25 …
一个具有O型和M型血型的个体与一个具有B型和MN型血型的个体婚配,其子女可能的血型为()A.O型和M 2020-11-01 …
如右图,质量分别为m和M的两个星球A和B在引力作用下都绕O点做匀速圆周运动,星球A和B两者中心之间的 2020-11-06 …
已知两个长度分别为m和n的升序链表若将它们合并为一个长度为m+n的降序链表,则最坏情况下的时间复杂度 2020-11-28 …
读某地近地面和高空四点气压图(单位:hPa)(如图),回答3-4题.若近地面和高空四点构成热力环流, 2020-12-04 …
(10分)如右图,质量分别为m和M的两个星球A和B在引力作用下都绕O点做匀速圆周运动,星球A和B两者 2020-12-16 …
社会实践是文化创造w*w^w.k&s#5@u.c~o*m和发展的基础。对此理解正确的有①文化创新的需 2020-12-19 …