早教吧作业答案频道 -->化学-->
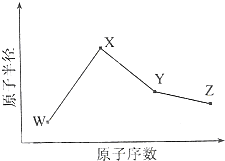
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的
题目详情
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
(1)X位于元素周期表中___;
(2)W的基态原子核外有___ 个未成对电子;
(3)Y的单质和Z单质相比,较活泼的是___(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是___(写化学式);
(4)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是___;
(5)在25°C、101kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程式是___.

(1)X位于元素周期表中___;
(2)W的基态原子核外有___ 个未成对电子;
(3)Y的单质和Z单质相比,较活泼的是___(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是___(写化学式);
(4)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是___;
(5)在25°C、101kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程式是___.
▼优质解答
答案和解析
W、X、Y、Z是四种常见的短周期元素,原子半径X>Y>Z>W;W的一种核素的质量数为18,中子数为10,其质子数为8,则W是O元素;
X和Ne原子的核外电子数相差1,其原子半径最大,为Na元素;
Y的单质是一种常见的半导体材料,则Y是Si元素;
Z的电负性在同周期主族元素中最大,且其原子半径大于O元素,则Z是Cl元素;
(1)X是Na元素,Na原子核外有3个电子层、最外层电子数为1,所以位于第三周期第IA族,故答案为:第三周期第IA族;
(2)W是O元素,其核外电子排布式为:1s22s22p4,其原子核外有2个未成对电子,故答案为:2;
(3)Y是Si元素、Z是Cl元素,同一周期元素,元素的非金属性随着原子序数增大而增强,元素的非金属性越强,其单质的活泼性越强,所以Y单质和Z单质相比,较活泼的是Cl2,元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>Br,所以氢化物较稳定的是HCl;
故答案为:Cl2;HCl;
(4)Y是Si元素、Z是Cl元素,二者形成的物质是四氯化硅,四氯化硅和水反应生成硅酸和HCl,反应方程式为SiCl4+3H2O=H2SiO3↓+4HCl,
故答案为:SiCl4+3H2O=H2SiO3↓+4HCl;
(4)Y的氢化物是硅烷,硅烷和氧气反应方程式为SiH4+2O2=SiO2+2H2O,该反应中转移电子数为8,平均每转移1mol 电子放热190.0kJ,则转移8mol电子放出热量1520.0KJ,则其热化学方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0KJ/mol,
故答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0KJ/mol.
X和Ne原子的核外电子数相差1,其原子半径最大,为Na元素;
Y的单质是一种常见的半导体材料,则Y是Si元素;
Z的电负性在同周期主族元素中最大,且其原子半径大于O元素,则Z是Cl元素;
(1)X是Na元素,Na原子核外有3个电子层、最外层电子数为1,所以位于第三周期第IA族,故答案为:第三周期第IA族;
(2)W是O元素,其核外电子排布式为:1s22s22p4,其原子核外有2个未成对电子,故答案为:2;
(3)Y是Si元素、Z是Cl元素,同一周期元素,元素的非金属性随着原子序数增大而增强,元素的非金属性越强,其单质的活泼性越强,所以Y单质和Z单质相比,较活泼的是Cl2,元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>Br,所以氢化物较稳定的是HCl;
故答案为:Cl2;HCl;
(4)Y是Si元素、Z是Cl元素,二者形成的物质是四氯化硅,四氯化硅和水反应生成硅酸和HCl,反应方程式为SiCl4+3H2O=H2SiO3↓+4HCl,
故答案为:SiCl4+3H2O=H2SiO3↓+4HCl;
(4)Y的氢化物是硅烷,硅烷和氧气反应方程式为SiH4+2O2=SiO2+2H2O,该反应中转移电子数为8,平均每转移1mol 电子放热190.0kJ,则转移8mol电子放出热量1520.0KJ,则其热化学方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0KJ/mol,
故答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0KJ/mol.
看了W、X、Y、Z是四种常见的短周...的网友还看了以下:
在圆心为O、半径为常数R的半圆板内画内接矩形(如图),当矩形的长和宽各取多少时,矩形的面积最大?求 2020-05-13 …
原子半径问题书上说上一周期最左边的原子半径一定比下一周期最右边的原子半径大,为什么?当最外层电子数 2020-07-20 …
高一数学的半倍角公式有哪些啊? 2020-08-02 …
满足某些特定条件的集族称为半环,这里的半环和抽象代数中的半环是什么关系? 2020-11-06 …
一、原子半径同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减;一、原子半径 2020-11-17 …
有一个六位数前三个数字都是奇数,后三个数字都是偶数,把后半部分移到前面,读数是原数五倍半,原数是. 2020-11-17 …
离子半径问题首先看其电子层结构,如果电子层数不同,则层数大的其半径就大,如果电子层数相同,其原子序数 2020-11-20 …
离子半径大小微粒半径Na+<K+<Cl-<S2-这个到底怎么判断?是对是错?我知道质子数少的半径大. 2020-11-26 …
为什么同周期的元素,原子半径从左到右逐渐减小原子半径是什么?金属原子半径指固态金属单质里2个邻近原子 2020-11-27 …
有一块半径为R(R为正常数)的半圆形空地,开发商计划征地建一个游泳池ABCD和其附属设施,附属设施占 2020-12-04 …