早教吧作业答案频道 -->化学-->
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.(1)组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是(2)氧硫化碳(COS)的电
题目详情
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.
(1)组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是___
(2)氧硫化碳(COS)的电子式为:___.
(3)下列事实正确且能说明碳与硫两元素非金属性相对强弱的有___
A.同条件同浓度溶液pH:Na2CO3>Na2SO4
B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
D.分解温度:CH4>H2S
(4)氧硫化碳水解及部分应用流程如下(部分产物已略去):
COS
H2S
Na2S溶液
M溶液+H2
①已知:常温下,反应Ⅱ中每吸收1.7gH2S气体,反应放出热量4.76kJ,则该反应的热化学方程式为___
②已知M溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成S2O32-的离子方程式为___
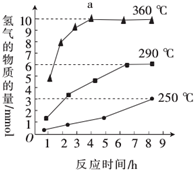
③如图是反应Ш中,在不同反应温度下,反应时间与H2产量的关系(Na2 S初始含量为3 mmol).由图象分析可知,a点时M溶液中除S2O32-外,还有___(填含硫微粒的 离子符号).

(1)组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是___
(2)氧硫化碳(COS)的电子式为:___.
(3)下列事实正确且能说明碳与硫两元素非金属性相对强弱的有___
A.同条件同浓度溶液pH:Na2CO3>Na2SO4
B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
D.分解温度:CH4>H2S
(4)氧硫化碳水解及部分应用流程如下(部分产物已略去):
COS
| H2O |
| |
| Ⅰ |
| NaOH溶液 |
| |
| Ⅱ |
| △ |
| |
| Ⅲ |
①已知:常温下,反应Ⅱ中每吸收1.7gH2S气体,反应放出热量4.76kJ,则该反应的热化学方程式为___
②已知M溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成S2O32-的离子方程式为___
③如图是反应Ш中,在不同反应温度下,反应时间与H2产量的关系(Na2 S初始含量为3 mmol).由图象分析可知,a点时M溶液中除S2O32-外,还有___(填含硫微粒的 离子符号).
▼优质解答
答案和解析
(1)组成氧硫化碳和磷化氢的原子为O、S、P、H,氢元素有1个电子层,氧元素有2个电子层,磷、硫有3个电子层,所以磷、硫的原子半径大于氢、氧的原子半径,磷、硫是同周期元素,硫的原子序数大于磷的原子序数,由元素周期律知,磷的原子半径大于硫的原子半径,磷最外层为5个电子,处于第三周期第VA族,
故答案为:第三周期第VA族;
(2)羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为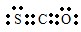 ,
,
故答案为: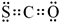 ;
;
(3)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度以及最高正价氧化物对应水化物酸性强弱等角度,而最高正化合价、氢化物的沸点高低不能用于比较元素的非金属性强弱,
A.同条件同浓度溶液pH:Na2CO3>Na2SO4,说明碳酸酸性小于硫酸,最高价氧化物对应水化物形成的酸的酸性越强对应非金属性越强,故A正确;
B.酸性:H2SO3>H2CO3 ,亚硫酸不是最高价氧化物,不能判断非金属性强弱,故B错误;
C.CS2中碳元素为+4价,硫元素为-2价,说明硫元素对共用电子对的吸引力较强,说明非金属性:S>C,故C正确;
D.一般来说,元素的气态氢化物越稳定,则元素的非金属性越强,分解温度:CH4>H2S,氢化物的稳定性顺序是CH4>H2S,但S的非金属性强于碳元素,故D错误;
故答案为:AC;
(4)①反应Ⅱ为硫化氢和氢氧化钠的反应H2S+2NaOH=Na2S+H2O,1.7g H2S的物质的量为n=
=
=0.5mol,反应放出热量4.76kJ,则1mol硫化氢反应放出95.2KJ的热量,所以该反应的热化学方程式为H2S(g)+2NaOH(aq)=Na2S(aq)+2H2O(l)△H=-95.2KJ/mol,
故答案为:H2S(g)+2NaOH(aq)=Na2S(aq)+2H2O(l)△H=-95.2KJ/mol;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,根据硫原子守恒,产物需有因离子,根据原子守恒,产物还有氢氧根离子,反应为:2S2-+5H2O
S2O32-+4H2↑+2OH-,
故答案为:2S2-+5H2O
S2O32-+4H2↑+2OH-;
③反应Ⅲ中,a点360℃时,随着时间推移,氢气的量不变,Na2S初始含量为3mmol,若只发生:2S2-+5H2O
S2O32-+4H2↑+2OH-,生成氢气:3mmol×
=6mmol,图中为9mmol,说明M溶液中除S2O32-外,还有SO42-,反应为:S2-+4H2O
SO42-+4H2↑,
故答案为:SO42-.
故答案为:第三周期第VA族;
(2)羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为
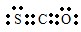 ,
,故答案为:
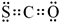 ;
;(3)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度以及最高正价氧化物对应水化物酸性强弱等角度,而最高正化合价、氢化物的沸点高低不能用于比较元素的非金属性强弱,
A.同条件同浓度溶液pH:Na2CO3>Na2SO4,说明碳酸酸性小于硫酸,最高价氧化物对应水化物形成的酸的酸性越强对应非金属性越强,故A正确;
B.酸性:H2SO3>H2CO3 ,亚硫酸不是最高价氧化物,不能判断非金属性强弱,故B错误;
C.CS2中碳元素为+4价,硫元素为-2价,说明硫元素对共用电子对的吸引力较强,说明非金属性:S>C,故C正确;
D.一般来说,元素的气态氢化物越稳定,则元素的非金属性越强,分解温度:CH4>H2S,氢化物的稳定性顺序是CH4>H2S,但S的非金属性强于碳元素,故D错误;
故答案为:AC;
(4)①反应Ⅱ为硫化氢和氢氧化钠的反应H2S+2NaOH=Na2S+H2O,1.7g H2S的物质的量为n=
| m |
| M |
| 17g |
| 34g/mol |
故答案为:H2S(g)+2NaOH(aq)=Na2S(aq)+2H2O(l)△H=-95.2KJ/mol;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,根据硫原子守恒,产物需有因离子,根据原子守恒,产物还有氢氧根离子,反应为:2S2-+5H2O
| ||
故答案为:2S2-+5H2O
| ||
③反应Ⅲ中,a点360℃时,随着时间推移,氢气的量不变,Na2S初始含量为3mmol,若只发生:2S2-+5H2O
| ||
| 4 |
| 2 |
| ||
故答案为:SO42-.
看了氧硫化碳(COS)可替代磷化氢...的网友还看了以下:
英语翻译摘要:本文通过对梵高不同时期的作品中的特点进行解读,阐述其绘画风格形成的原因和其绘画过程中 2020-05-13 …
“2006中国意大利年”主题海报──“意向中国”中的大卫像取自于文艺复兴时期的作品,该作品所体现的 2020-05-16 …
巴赫是哪个时期的作曲家?A.巴洛克时期B.古典时期C.浪漫时期 2020-05-16 …
在你长期的作文实践中,你认为写作中最重要的是什么? 2020-05-16 …
2.汉乐府民歌流传至今的多为东汉时期的作品()正确不正确3.《咏史》被称为早期文人五言诗的典范之作 2020-06-06 …
《武陵春》一词是诗人哪个时期的作品李清照的词以南渡为界分为两个时期,《武陵春》一词应是词人哪个时期 2020-06-09 …
前期创作中期制作后期制作翻译成英文怎么说 2020-07-01 …
毛泽东对中国革命的性质、对象、任务、动力和前途等一系列问题进行系统论述的时间和著作是A.大革命时期 2020-07-01 …
公务员的逻辑题,不会做,求高手讲解作家在其晚期的作品中没有像其早期那样严格遵守小说结构的成规。由于 2020-07-15 …
青铜奔马是中国什么时期的作品春秋?西汉?东汉?还是战国时期? 2020-07-21 …