早教吧作业答案频道 -->化学-->
某中药主要含二硫化亚铁(FeS2),某学习小组欲用如图所示装置进行实验.测定其铁、硫元素的质量分数.取mg该中药样品于装置A中,经充分反应,使硫元素全部转化为SO2和SO3.已知:A为
题目详情
某中药主要含二硫化亚铁(FeS2),某学习小组欲用如图所示装置进行实验.测定其铁、硫元素的质量分数.取mg该中药样品于装置A中,经充分反应,使硫元素全部转化为SO2和SO3.
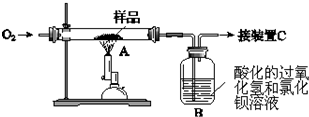
已知:A为高温灼烧装置,C为检测尾气中是否含有SO2的传感器.实验结束后,传感器(装置C)未检测到SO2.
I:硫元素质量分数的测定:
(1)装置B中加入H2O2的作用是___.
(2)用50%双氧水配制20%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要___(填仪器名称)
(3)欲计算硫元素的质量分数,需测量的数据是___.
(4)从安全角度出发,你认为该实验还需要改进的措施___.
Ⅱ:铁元素质量分数的测定步骤如下:
a.将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生.充分反应后过滤,得到黄色滤液;
b.向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被氧化为TiO2+;
c. 将b中所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,用硫酸酸化的KMnO4(c mol•L-1)标准液滴定终点,测得消耗酸性KMnO4溶液体积的平均值为V mL.
(5)检验步骤a中滤液是否存在+3价的铁,可选用的试剂为___ (填序号)
A.铜粉 B.H2O2溶液 C.KSCN溶液 D. KMnO4溶液
(6)步骤b中反应的离子方程式是___.
(7)步骤c中确认滴定终点的现象是:最后一滴液体加入,溶液变成___色,且半分钟内无变化.样品中铁元素质量分数的数学表示式是___(用含m、c、V的代数式表示).

已知:A为高温灼烧装置,C为检测尾气中是否含有SO2的传感器.实验结束后,传感器(装置C)未检测到SO2.
I:硫元素质量分数的测定:
(1)装置B中加入H2O2的作用是___.
(2)用50%双氧水配制20%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要___(填仪器名称)
(3)欲计算硫元素的质量分数,需测量的数据是___.
(4)从安全角度出发,你认为该实验还需要改进的措施___.
Ⅱ:铁元素质量分数的测定步骤如下:
a.将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生.充分反应后过滤,得到黄色滤液;
b.向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被氧化为TiO2+;
c. 将b中所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,用硫酸酸化的KMnO4(c mol•L-1)标准液滴定终点,测得消耗酸性KMnO4溶液体积的平均值为V mL.
(5)检验步骤a中滤液是否存在+3价的铁,可选用的试剂为___ (填序号)
A.铜粉 B.H2O2溶液 C.KSCN溶液 D. KMnO4溶液
(6)步骤b中反应的离子方程式是___.
(7)步骤c中确认滴定终点的现象是:最后一滴液体加入,溶液变成___色,且半分钟内无变化.样品中铁元素质量分数的数学表示式是___(用含m、c、V的代数式表示).
▼优质解答
答案和解析
Ⅰ、(1)取m g该中药样品于装置A中,经充分反应,FeS2燃烧生成二氧化硫和氧化铁,二氧化硫通入酸化的过氧化氢和氯化钡溶液中,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,发生氧化还原反应生成硫酸钡沉淀;过氧化氢的主要作用是氧化剂氧化+4价硫为+6价硫酸根离子,装置B中的H2O2反应时表现出了氧化性;
故答案为:将SO2氧化,使之完全转化成BaSO4沉淀;
(2)实验操作分析需要的玻璃仪器有,量取液体的量筒,溶解需要的烧杯,玻璃棒,定容需要的胶头滴管等,用50%双氧水配制20%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要量筒,
故答案为:量筒;
(3)欲计算硫元素的质量分数,需要测定B中沉淀质量计算硫元素物质的量,所以测量的数据是B中沉淀的质量,故答案为:B中沉淀的质量;
(4)A装置处是高温加热,气体压强变化会引起装置B中的液体倒流分析可知,从安全角度出发,该实验还需要改进的措施是在A、B装置之间连接一个防倒吸装置,
故答案为:在A、B装置之间连接一个防倒吸装置;
Ⅱ、(5)滤液是否存在+3价的铁可以利用铁离子检验试剂分析,与硫氰酸钾溶液生成血红色溶液,铜粉溶解,不能被过氧化氢、高锰酸钾氧化,所以可选用的试剂为AC,
故答案为:AC;
(6)向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被铁离子氧化为TiO2+,反应的离子方程式为:Fe3++Ti3++H2O=Fe2++TiO2++2H+;
故答案为:Fe3++Ti3++H2O=Fe2++TiO2++2H+;
(7)用滴定法测定Fe2+的量,用硫酸酸化的KMnO4(c mol•L-1)标准液滴定终点,反应终点可以依据高锰酸钾溶液的颜色指示终点,滴入最后一滴溶液变化为紫红色,且半分钟内无变化.说明反应达到反应终点.
将b中所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,用硫酸酸化的KMnO4(c mol•L-1)标准液滴定终点,测得消耗酸性KMnO4溶液体积的平均值为V mL.
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
5 1
n
×c mol•L-1×V×10-3L
n=0.02CVmol
样品中铁元素质量分数的数学表示式=
×100%=
×100%;
故答案为:紫红;
×100%.
故答案为:将SO2氧化,使之完全转化成BaSO4沉淀;
(2)实验操作分析需要的玻璃仪器有,量取液体的量筒,溶解需要的烧杯,玻璃棒,定容需要的胶头滴管等,用50%双氧水配制20%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要量筒,
故答案为:量筒;
(3)欲计算硫元素的质量分数,需要测定B中沉淀质量计算硫元素物质的量,所以测量的数据是B中沉淀的质量,故答案为:B中沉淀的质量;
(4)A装置处是高温加热,气体压强变化会引起装置B中的液体倒流分析可知,从安全角度出发,该实验还需要改进的措施是在A、B装置之间连接一个防倒吸装置,
故答案为:在A、B装置之间连接一个防倒吸装置;
Ⅱ、(5)滤液是否存在+3价的铁可以利用铁离子检验试剂分析,与硫氰酸钾溶液生成血红色溶液,铜粉溶解,不能被过氧化氢、高锰酸钾氧化,所以可选用的试剂为AC,
故答案为:AC;
(6)向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被铁离子氧化为TiO2+,反应的离子方程式为:Fe3++Ti3++H2O=Fe2++TiO2++2H+;
故答案为:Fe3++Ti3++H2O=Fe2++TiO2++2H+;
(7)用滴定法测定Fe2+的量,用硫酸酸化的KMnO4(c mol•L-1)标准液滴定终点,反应终点可以依据高锰酸钾溶液的颜色指示终点,滴入最后一滴溶液变化为紫红色,且半分钟内无变化.说明反应达到反应终点.
将b中所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,用硫酸酸化的KMnO4(c mol•L-1)标准液滴定终点,测得消耗酸性KMnO4溶液体积的平均值为V mL.
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
5 1
n
| 100 |
| 25 |
n=0.02CVmol
样品中铁元素质量分数的数学表示式=
| 0.02CVmol×56g/mol |
| m |
| 1.12CV |
| m |
故答案为:紫红;
| 1.12CV |
| m |
看了某中药主要含二硫化亚铁(FeS...的网友还看了以下:
甲车从M点、乙车从N点同时相向运动,它们的s-t图象分别如图(a)、(b)所示,当甲、乙相遇时.乙 2020-05-16 …
求纠错!输入整数 m 和正整数 n ,按下列公式计算 s输入整数 m 和正整数 n ,按下列公式计 2020-05-17 …
如图是某物体的s-t图象,由图象可知前5s内物体通过的路程是m,在5s-15s内物体运动的速度是m 2020-07-13 …
已知集合M、P、S,满足M∪P=M∪S,则()A.P=SB.M∩P=M∩SC.M∩(P∪S)=M∩ 2020-07-30 …
已知集合M.P.S,满足M∪P=M∪S,则正确的是:A.P=SB.M∩P=M∩SC.M∩(P∪S) 2020-07-30 …
某司机在检测汽车性能过程中,得到汽车减速过程中的位移s与速度v的关系曲线如图所示,并得出位移s与速 2020-08-03 …
如图所示为A、B、C三个物体作直线运动的s-t图.三个物体位移大小分别为,,.三个物体的平均速度分 2020-08-03 …
如图的程序框图(未完成).设当箭头a指向①时,输出的结果s=m,当箭头a指向②时,输出的结果s=n, 2020-11-27 …
如图所示Ⅰ、Ⅱ是在透镜主光轴PQ上的点光源S(图中未画出)经过透镜折射后的发散光线,图中L是透镜所在 2020-12-15 …
如图是小刚从家中出发到达学校的s-t图象,其中一半路程步行,一半路程骑自行车.小刚步行对应图象中(选 2021-01-29 …