早教吧作业答案频道 -->化学-->
硫酸是基础化工的重要产品,硫酸的消费量可作为衡量一个国家工业发展水平的标志.生产硫酸的主要反应为:SO2(g)+12O2(g)SO3(g)(1)恒温恒容下,平衡体系中SO3
题目详情
硫酸是基础化工的重要产品,硫酸的消费量可作为衡量一个国家工业发展水平的标志.生产硫酸的主要反应为:SO2(g)+
O2(g)SO3(g)
(1)恒温恒容下,平衡体系中SO3的体积分数[ϕ(SO3)]和y与SO2、O2的物质的量之比
的关系如图1:
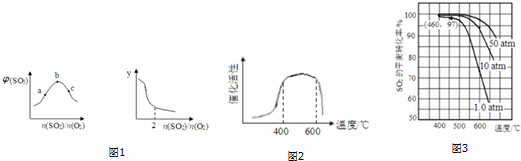
则b点
=___;y为___(填编号).
A.平衡常数 B.SO3的平衡产率 C.O2的平衡转化率 D.SO2的平衡转化率.
(2)Kp是以各气体平衡分压代替浓度平衡常数Kc中各气体的浓度的平衡常数.在400~650℃时,Kp与温度(T/K)的关系为lgKp=-4.6455,则在此条件下SO2转化为SO3反应的△H___(填“>0”或“<0”).
(3)①该反应的催化剂为V2O5,其催化反应过程为:
SO2+V2O5⇌SO3+V2O4K1
O2+V2O4⇌V2O5K2
则在相同温度下2SO2(g)+O2(g)2SO3(g)的平衡常数K=___(以含K1、K2的代数式表示).
②V2O5加快反应速率的原因是___,其催化活性与温度的关系如图2:
(4)在7.0% SO2、11% O2、82% N2时,SO2平衡转化率与温度、压强的关系如图3:
则460℃、1.0atm下,SO2(g)+
O2(g)SO3(g)的Kp=___ (各气体的分压=总压×各气体的体积分数).(已知:=0.28)
(5)压强通常采用常压的原因是___,综合第(3)、(4)题图给信息,工业生产最适宜的温度范围400℃-500℃,你认为最主要的原因是___.
A.原料转化率最大 B.已达到反应装置所能承受的最高温度 C.催化剂的活性最高.
| 1 |
| 2 |
(1)恒温恒容下,平衡体系中SO3的体积分数[ϕ(SO3)]和y与SO2、O2的物质的量之比
| n(SO2) |
| n(O2) |

则b点
| n(SO2) |
| n(O2) |
A.平衡常数 B.SO3的平衡产率 C.O2的平衡转化率 D.SO2的平衡转化率.
(2)Kp是以各气体平衡分压代替浓度平衡常数Kc中各气体的浓度的平衡常数.在400~650℃时,Kp与温度(T/K)的关系为lgKp=-4.6455,则在此条件下SO2转化为SO3反应的△H___(填“>0”或“<0”).
(3)①该反应的催化剂为V2O5,其催化反应过程为:
SO2+V2O5⇌SO3+V2O4K1
| 1 |
| 2 |
则在相同温度下2SO2(g)+O2(g)2SO3(g)的平衡常数K=___(以含K1、K2的代数式表示).
②V2O5加快反应速率的原因是___,其催化活性与温度的关系如图2:
(4)在7.0% SO2、11% O2、82% N2时,SO2平衡转化率与温度、压强的关系如图3:
则460℃、1.0atm下,SO2(g)+
| 1 |
| 2 |
(5)压强通常采用常压的原因是___,综合第(3)、(4)题图给信息,工业生产最适宜的温度范围400℃-500℃,你认为最主要的原因是___.
A.原料转化率最大 B.已达到反应装置所能承受的最高温度 C.催化剂的活性最高.
▼优质解答
答案和解析
(1)当二氧化硫的量与氧气的物质的量之比等于系数之比时三氧化硫的体积分数最大,b点三氧化硫体积分数最大,此点处n(SO2)/n(O2)=2:1;
由图象可知,n(SO2)/n(O2)越大,y值越小,
A.平衡常数仅与温度有关,所以n(SO2)/n(O2)变化,平衡常数不变,不符合图象,故错误;
B.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则SO3的平衡产率越大,不符合图象,故错误;
C.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则O2的转化率越大,不符合图象,故错误;
D.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则SO2的平衡转化率越小,符合图象,故正确;
故答案为:2;D;
(2)根据lgKp=
-4.6455知,升高温度平衡常数减小,说明平衡逆向移动,正反应是放热反应,焓变小于0,
故答案为:<0;
(3)①将方程式2(①+②)得2SO2(g)+O2(g)⇌2SO3(g),方程式相加平衡常数相乘,方程式扩大2倍,平衡常数变为原来的平方,所以该反应化学平衡常数K等于(K1×K2)2,故答案为:(K1×K2)2;
②催化剂通过降低反应的活化能,活化分子百分数增大,有效碰撞几率提高,从而增大反应速率,
故答案为:降低反应的活化能,活化分子百分数增大,有效碰撞几率提高;
(4)混合气体中7.0% SO2、11% O2、82% N2,假设有混合气体100mol,则二氧化硫为7mol、氧气11mol、氮气82mol,460℃、1.0atm下二氧化硫转化率为97%,则参加反应的n(SO2)=7mol×97%=6.79mol,
剩余的n(SO2)=7mol×3%=0.21mol,
剩余的n(O2)=11mol-
×6.79mol=7.605mol,生成的三氧化硫物质的量=6.79mol,反应后混合气体总物质的量=0.21mol+7.605mol+6.79mol+82mol=96.605mol,
反应前后物质的量之比等于其压强之比,
则反应后压强=
×1atm=0.9579atm,
二氧化硫的分压=
×0.9579atm,
氧气分压=
×0.9579atm,
三氧化硫分压=
×0.9579atm,
化学平衡常数Kp=
=
=113atm
,
故答案为:113atm
;
(5)根据图知,在400~500℃时二氧化硫转化率较大,反应速率快,所以工业生产最适宜的温度范围为400~500℃,又常压下SO2的平衡转化率已经很大,再增大压强,对设备要求较高,工业生产最适宜的温度范围400℃-500℃,此时催化剂的活性最高,
故答案为:常压下SO2的平衡转化率已经很大,再增大压强,对设备要求较高,C.
由图象可知,n(SO2)/n(O2)越大,y值越小,
A.平衡常数仅与温度有关,所以n(SO2)/n(O2)变化,平衡常数不变,不符合图象,故错误;
B.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则SO3的平衡产率越大,不符合图象,故错误;
C.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则O2的转化率越大,不符合图象,故错误;
D.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则SO2的平衡转化率越小,符合图象,故正确;
故答案为:2;D;
(2)根据lgKp=
| 4905.5 |
| T |
故答案为:<0;
(3)①将方程式2(①+②)得2SO2(g)+O2(g)⇌2SO3(g),方程式相加平衡常数相乘,方程式扩大2倍,平衡常数变为原来的平方,所以该反应化学平衡常数K等于(K1×K2)2,故答案为:(K1×K2)2;
②催化剂通过降低反应的活化能,活化分子百分数增大,有效碰撞几率提高,从而增大反应速率,
故答案为:降低反应的活化能,活化分子百分数增大,有效碰撞几率提高;
(4)混合气体中7.0% SO2、11% O2、82% N2,假设有混合气体100mol,则二氧化硫为7mol、氧气11mol、氮气82mol,460℃、1.0atm下二氧化硫转化率为97%,则参加反应的n(SO2)=7mol×97%=6.79mol,
剩余的n(SO2)=7mol×3%=0.21mol,
剩余的n(O2)=11mol-
| 1 |
| 2 |
反应前后物质的量之比等于其压强之比,
则反应后压强=
| 0.21mol+7.605mol+6.79mol+82mol |
| 100mol |
二氧化硫的分压=
| 0.21mol |
| 96.605mol |
氧气分压=
| 7.605mol |
| 96.605mol |
三氧化硫分压=
| 6.79mol |
| 96.605mol |
化学平衡常数Kp=
| P(SO3) | ||
P(SO2)×
|
| ||||||
|
| 1 |
| 2 |
故答案为:113atm
| 1 |
| 2 |
(5)根据图知,在400~500℃时二氧化硫转化率较大,反应速率快,所以工业生产最适宜的温度范围为400~500℃,又常压下SO2的平衡转化率已经很大,再增大压强,对设备要求较高,工业生产最适宜的温度范围400℃-500℃,此时催化剂的活性最高,
故答案为:常压下SO2的平衡转化率已经很大,再增大压强,对设备要求较高,C.
看了硫酸是基础化工的重要产品,硫酸...的网友还看了以下:
天体系统层次示意图,图中O为地球所在的天体系统,P为某一天体.完成1-2题.若R=38.4×104 2020-05-16 …
(203秋•兴庆区校级月考)天体系统层示意图,图中为球所在的天系统P为某一天.成1-2题/格//A 2020-05-16 …
懂气体浓度计算的朋友帮我算算这道题吧,急!假设空气中只存在SO2一种物质,起浓度恒定为20ppbv 2020-05-20 …
已知动直线l过点P(4,0).交抛物线y^2=2mx(m>0)于A,B两点,O为原点,Q是P关于O 2020-06-07 …
一轮胎在水平地面上沿着一直线无滑动地滚动,轮胎中心以恒定的速率V0向前移动,轮胎半径为R,在t=0 2020-07-02 …
在298K时,当SO2在1升CHCl3中有1mol时,液面上SO2平衡分压为53.7kPa;当SO 2020-07-22 …
如图所示,M、N和P是以MN为直径的半圆弧上的三点,O为半圆弧的圆心,∠MOP=60°,在M、N处 2020-07-29 …
1966年,范克等人提出用H2O,SO2和I2为原料进行热化学循环制氢法:2H2O(l)+SO2(g 2020-10-30 …
在t摄氏度下,某反应达到平衡,平衡常数K=c(NO)c(SO3)/c(NO2)c(SO2).恒容时, 2020-12-25 …
配合下在2:00的时候解决1.SO2和SO3中S%=48%则SO2%=?2.O2和SO2中O%=60 2021-01-13 …