早教吧作业答案频道 -->化学-->
辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质.研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰和碱式碳
题目详情
辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有 MnO2,以及少量SiO2、Fe2O3等杂质.研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰和碱式碳酸铜.主要工艺流程如下:
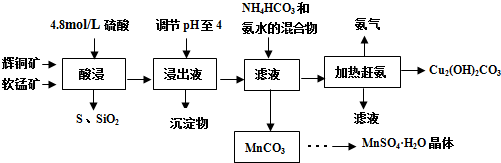
已知:①MnO2有较强的氧化性,能将Cu+氧化成Cu2+
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
(1)实验室配制250mL 4.8mol/L的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要___
(2)酸浸时,为了提高浸取率可采取的措施有___(任写一点).
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等.写出该反应的化学方程式___.
(4)调节浸出液pH=4的作用是___.
(5)本工艺中可循环使用的物质是(写化学式)___.
(6)获得的MnSO4•H2O晶体后常用酒精洗涤,优点是___.
(7)用标准的BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有___ (任写一种).

已知:①MnO2有较强的氧化性,能将Cu+氧化成Cu2+
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
(1)实验室配制250mL 4.8mol/L的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要___
(2)酸浸时,为了提高浸取率可采取的措施有___(任写一点).
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等.写出该反应的化学方程式___.
(4)调节浸出液pH=4的作用是___.
(5)本工艺中可循环使用的物质是(写化学式)___.
(6)获得的MnSO4•H2O晶体后常用酒精洗涤,优点是___.
(7)用标准的BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有___ (任写一种).
▼优质解答
答案和解析
(1)配制一定物质的量浓度的溶液,必不可少的是容量瓶和胶头滴管,容量瓶要标明规格,本题必须使用250mL容量瓶,
故答案为:250mL容量瓶、胶头滴管;
(2)由于酸浸时矿石颗粒大小影响浸取率,可以通过粉碎矿石提高浸取率,还可以适当升高温度或者搅拌提高浸取率,
故答案为:粉碎矿石、适当升高温度或者搅拌;
(3)根据信息,MnO2能将金属硫化物中的硫氧化为单质硫,反应物是Cu2S、MnO2、H2SO4 ,生成物是CuSO4、MnSO4、S,
把硫化亚铜看成整体,化合价变化是:(1×2+2×1)=4,
Mn元素化合价变化是:4-2=2,
所以二氧化锰化学计量数是2,硫化亚铜的是1,再根据观察法配平其它物质;反应的化学方程式是:Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O,
故答案为:Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O;
(4)根据金属阳离子生成氢氧化物沉淀的pH范围,使Fe3+完全沉淀且Cu2+不沉淀的PH范围是:3.2~4.4,故选择PH=4目的是使Fe3+完全水解生成氢氧化铁沉淀,
故答案为:使Fe3+完全生成Fe(OH)3沉淀;
(5)工艺流程中,加入了氨水,最后又得到了氨气,NH3 可循环使用,故答案为:NH3 ;
(6)在酒精中,硫酸锰晶体溶解度小,故获得的MnSO4•H2O晶体后常用酒精洗涤,目的是减少MnSO4•H2O晶体的损失,
故答案为:减少MnSO4•H2O晶体的损失;
(7)质量分数大于100%,说明了硫酸锰晶体中可能混有硫酸盐杂质或部分晶体失去结晶水,故答案为:混有硫酸盐杂质或部分晶体失去结晶水.
故答案为:250mL容量瓶、胶头滴管;
(2)由于酸浸时矿石颗粒大小影响浸取率,可以通过粉碎矿石提高浸取率,还可以适当升高温度或者搅拌提高浸取率,
故答案为:粉碎矿石、适当升高温度或者搅拌;
(3)根据信息,MnO2能将金属硫化物中的硫氧化为单质硫,反应物是Cu2S、MnO2、H2SO4 ,生成物是CuSO4、MnSO4、S,
把硫化亚铜看成整体,化合价变化是:(1×2+2×1)=4,
Mn元素化合价变化是:4-2=2,
所以二氧化锰化学计量数是2,硫化亚铜的是1,再根据观察法配平其它物质;反应的化学方程式是:Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O,
故答案为:Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O;
(4)根据金属阳离子生成氢氧化物沉淀的pH范围,使Fe3+完全沉淀且Cu2+不沉淀的PH范围是:3.2~4.4,故选择PH=4目的是使Fe3+完全水解生成氢氧化铁沉淀,
故答案为:使Fe3+完全生成Fe(OH)3沉淀;
(5)工艺流程中,加入了氨水,最后又得到了氨气,NH3 可循环使用,故答案为:NH3 ;
(6)在酒精中,硫酸锰晶体溶解度小,故获得的MnSO4•H2O晶体后常用酒精洗涤,目的是减少MnSO4•H2O晶体的损失,
故答案为:减少MnSO4•H2O晶体的损失;
(7)质量分数大于100%,说明了硫酸锰晶体中可能混有硫酸盐杂质或部分晶体失去结晶水,故答案为:混有硫酸盐杂质或部分晶体失去结晶水.
看了 辉铜矿主要成分Cu2S,此外...的网友还看了以下:
在正方体ABCD-A1B1C1D1中,O是BD1中点,A1C交平面AB1D1于M.则以下说法中:( 2020-05-17 …
证明o(x^m)+o(x^n)=o(x^m)(x→0)(n>m>0)过程请详细一些,谢谢啦请问其中 2020-06-12 …
已知在正方体ABCD-A1B1C1D1中,O是DB的中点,直线A1C交平面C1BD于点M,判断下列 2020-07-09 …
查阅资料:42O、M口O在高温下与4难反应,但能与SiO2反应.硫铁矿烧渣是一种工业废渣(含Fe2 2020-07-19 …
在三角形ABC中角C等于90度角A等于30,O是AB上一点,BO等于M.圆O的半径为1/2(1)当 2020-07-26 …
推断题:现有如下反应(反应条件均不给),推断物质⑴A→B+C+D⑵C+E→C+F+D⑶D+G→H⑷ 2020-07-30 …
如图,P和Q为带电量分别为+q和-q的两个等量异种电荷,两者相距为L,O为PQ连线的中点,M、N为 2020-08-01 …
如图所示,A、B两点分别放有电荷量为-Q何-2Q的点电荷,C、D位于AB连线上,且AC=CD=DB 2020-08-01 …
如图,点A、B、P在⊙O上,且∠APB=50°.若点M是⊙O上的动点,要使△ABM为等腰三角形,则 2020-08-03 …
一个作简谐运动的质点在平衡位置O点附近振动,当质点从O点向某一侧运动时,经过3s第一次过M点,再向前 2020-12-15 …