早教吧作业答案频道 -->化学-->
草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4•2H2O工艺流程如下:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、M
题目详情
草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4•2H2O工艺流程如下:
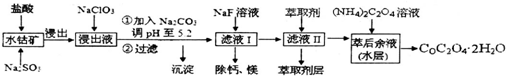
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3的目的是___.
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为___
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:___
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液
=___.
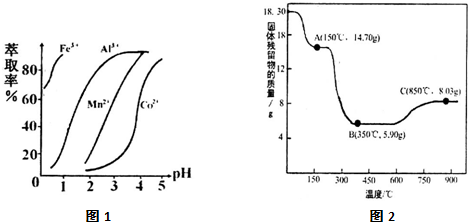
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,在滤液II中适宜萃取的pH为___左右.
(6)已知:NH3•H2O⇌NH4++OH- Kb=1.8×10-5;
H2C2O4⇌H++HC2O4- Ka1=5.4×10-2;HC2O4-⇌H+C2O42- Ka2=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH___7(填“>”或“<”或“=”)
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是___

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为___
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:___
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液
| c(Mg2+) |
| c(Ca2+) |
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,在滤液II中适宜萃取的pH为___左右.
(6)已知:NH3•H2O⇌NH4++OH- Kb=1.8×10-5;
H2C2O4⇌H++HC2O4- Ka1=5.4×10-2;HC2O4-⇌H+C2O42- Ka2=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH___7(填“>”或“<”或“=”)
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是___

▼优质解答
答案和解析
(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原,还原为Fe2+、Co2+,
故答案为:还原Fe3+、Co3+为Fe2+、Co2+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)Fe3+、Al3+水解导致溶液呈酸性,水解方程式为R3++3H2O⇌R(OH)3+3H+,:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,从而促进水解平衡向右移动,产生氢氧化铁、氢氧化铝沉淀,
故答案为:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O⇌R(OH)3+3H+,向右移动,而产生氢氧化物沉淀;
(4)当加入过量NaF后,所得滤液
=
=
=
=0.7,
故答案为:0.7;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:3.0~3.5;
(6)盐类水解,谁强显谁性,NH3•H2O⇌NH4++OH- Kb=1.8×10-5,HCO4-⇌H++C2O42- K a2=5.4×10-5,所以(NH4)2C2O4溶液中铵根离子水解大于草酸根离子水解,溶液呈酸性,即PH<7,
故答案为:<;
(7)由图可知,C点钴氧化物质量为8.03g,0.1molCo元素质量为5.9g,氧化物中氧元素质量为8.03g-5.9g=2.13g,则氧化物中Co原子与O原子物质的量之比为0.1mol:
≈3:4,故C的Co氧化物为Co3O4,
故答案为:Co3O4(或CoO•Co2O3).
故答案为:还原Fe3+、Co3+为Fe2+、Co2+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)Fe3+、Al3+水解导致溶液呈酸性,水解方程式为R3++3H2O⇌R(OH)3+3H+,:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,从而促进水解平衡向右移动,产生氢氧化铁、氢氧化铝沉淀,
故答案为:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O⇌R(OH)3+3H+,向右移动,而产生氢氧化物沉淀;
(4)当加入过量NaF后,所得滤液
| c(Mg2+) |
| c(Ca2+) |
| ||
|
| Ksp(MgF2) |
| Ksp(CaF2) |
| 7.35×10-11 |
| 1.05×10-10 |
故答案为:0.7;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:3.0~3.5;
(6)盐类水解,谁强显谁性,NH3•H2O⇌NH4++OH- Kb=1.8×10-5,HCO4-⇌H++C2O42- K a2=5.4×10-5,所以(NH4)2C2O4溶液中铵根离子水解大于草酸根离子水解,溶液呈酸性,即PH<7,
故答案为:<;
(7)由图可知,C点钴氧化物质量为8.03g,0.1molCo元素质量为5.9g,氧化物中氧元素质量为8.03g-5.9g=2.13g,则氧化物中Co原子与O原子物质的量之比为0.1mol:
| 2.13g |
| 16g/mol |
故答案为:Co3O4(或CoO•Co2O3).
看了草酸钴可用于指示剂和催化剂的制...的网友还看了以下:
四羟甲基硫酸膦杀菌剂有介绍四羟甲基硫酸膦,阳离子表面活性剂,还原性很强,可用作杀菌剂,其水溶液用于 2020-04-25 …
thanks17.用硫酸铁电化浸出黄铜矿精矿工艺中,精矿在阳极浸出的反应比较复杂,其中有一主要反应 2020-04-26 …
为什么用公式证后浮力不等于排开水的重力在实验中是吧一个正方体块放在一只溢水杯中这木块定会漂浮,定有 2020-05-14 …
物体所受浮力与所处液体黏度有关吗.比如说,物体浸没在自来水里和浸没在白粥里,所受浮力一样吗?假设有 2020-05-16 …
浮力等于重力在漂浮时物体不是完全浸没在液体里浮力=重力是等于浸在液体里的重力还是等于物体总重! 2020-05-16 …
下列不属于浸出药剂的是:( )A.酊剂B.流浸膏剂C.颗粒剂D.醑剂 2020-06-07 …
下列关于浸润和不浸润说法正确的是()A.一种液体是否浸润某种固体取决这两种物质的性质B.附着层中的 2020-07-21 …
关于浸润和不浸润,下面说法中正确的是()A.水是浸润液体,水银是不浸润液体B.鸭的羽毛上有一层很薄的 2020-11-26 …
关于浸润和不浸润,下面说法正确的是()A.水是浸润液体,水银是不浸润液体B.在内径小的容器里,如果液 2020-11-26 …
关于浸润与不浸润现象,下面的几种说法中正确的是[]A.水是浸润液体B.水银是不浸润液体C.同一种液体 2020-12-08 …