早教吧作业答案频道 -->化学-->
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反
题目详情
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为___.
(2)上述反应中的还原剂是___,反应产生的气体可用___吸收,吸收过程中发生的反应的离子方程式为___.
(3)As2S3和浓HNO3反应生成H3AsO4、S和NO2,写出该反应的化学方程式并用单线桥法表示电子转移的方向和数目:___;
(4)若其氧化产物的总物质的量比还原产物的总物质的量少0.8mol,则反应中转移电子的物质的量为___.
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为___.
(2)上述反应中的还原剂是___,反应产生的气体可用___吸收,吸收过程中发生的反应的离子方程式为___.
(3)As2S3和浓HNO3反应生成H3AsO4、S和NO2,写出该反应的化学方程式并用单线桥法表示电子转移的方向和数目:___;
(4)若其氧化产物的总物质的量比还原产物的总物质的量少0.8mol,则反应中转移电子的物质的量为___.
▼优质解答
答案和解析
(1)根据电子得失守恒知1molAs2S3作氧化剂得到2mol电子,而1molSnCl2作还原剂失去2mol电子,所以二者的物质的量之比是1:1,故答案为:1:1;
(2)反应中SnCl2中的Sn元素化合价升高,SnCl2为还原剂,H2S为酸性气体,可用NaOH溶液吸收,离子反应方程式为:H2S+2OH-=2H2O+S2-、S2-+H2S=2HS-,故答案为:SnCl2;NaOH溶液;H2S+2OH-=2H2O+S2-、S2-+H2S=2HS-;
(3)As2S3和浓HNO3反应生成H3AsO4、S和NO2,所以反应的化学方程式为:As2S3+10HNO3═2H3AsO4+3S↓+10NO2↑+2H2O,用单线桥法表示电子转移的方向和数目为: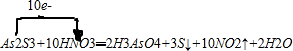 ,故答案为:
,故答案为: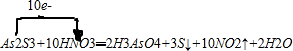 ;
;
(4)设反应中转移电子的物质的量为x,
2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,转移电子 氧化产物和还原产物的差
2 1mol
x 0.8mol
x=2×0.8=1.6mol,故答案为:1.6mol.
(2)反应中SnCl2中的Sn元素化合价升高,SnCl2为还原剂,H2S为酸性气体,可用NaOH溶液吸收,离子反应方程式为:H2S+2OH-=2H2O+S2-、S2-+H2S=2HS-,故答案为:SnCl2;NaOH溶液;H2S+2OH-=2H2O+S2-、S2-+H2S=2HS-;
(3)As2S3和浓HNO3反应生成H3AsO4、S和NO2,所以反应的化学方程式为:As2S3+10HNO3═2H3AsO4+3S↓+10NO2↑+2H2O,用单线桥法表示电子转移的方向和数目为:
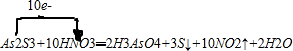 ,故答案为:
,故答案为: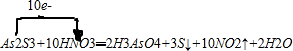 ;
;(4)设反应中转移电子的物质的量为x,
2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,转移电子 氧化产物和还原产物的差
2 1mol
x 0.8mol
x=2×0.8=1.6mol,故答案为:1.6mol.
看了雄黄(As4S4)和雌黄(As...的网友还看了以下:
下列对宏观事实的微观解释正确的是()事实解释A硝酸钾溶于水消失了分子不能运动B稀硫酸和稀盐酸都能使 2020-04-12 …
对下列化学事实的解释不正确的是()事实解释A玫瑰花香分子在不断运动B酸具有一些共同的性质酸溶液中的 2020-05-13 …
求下列各题的L.C.M(最小公倍数)1:28,42 2:50,753:15,20,45 4:8,1 2020-05-13 …
下列关于电解质溶液的叙述中正确的是A.Na2CO3、NaHCO3两种盐的溶液中,离子种类是Na2C 2020-05-14 …
从一个点A向斜上方与水平面成θ角方向抛掷一个物体B,初速度为V,抛到C点,C点的高度与A点差为H( 2020-05-14 …
有关酸和碱的说法不正确的是()A.不是所有的酸和碱都能发生中和反应B.酸在水中解离出来的阳离子全部 2020-05-14 …
铜上镀锌的时候电解液不是必须得有锌离子吗、可是电解池阳极的放电顺序是H+排在zn2+前面啊铜上镀锌 2020-07-15 …
将原油精炼为汽油、柴油、塑胶等各种不同产品,需要对原油进行冷却和加热.如果第xh时,原油的温度(单位 2020-12-02 …
请问记号“h.c.”在物理表达式中的含义是什么?(参见图片:这是一个标准模型中的希格斯-汤川作用.如 2020-12-08 …
下列说法正确的是()A.金刚石与石墨物理性质差异较大,是由于碳原子的结构不同B.盐酸与硫酸化学性质相 2021-01-10 …