早教吧作业答案频道 -->化学-->
氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi):(1)氮是地球上含量丰富的一种元素,工业上用N2和H2合成NH3.①已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ•mol-1N2(g)+O2(
题目详情
氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi):
(1)氮是地球上含量丰富的一种元素,工业上用N2和H2合成NH3.
①已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ•mol-1
N2(g)+O2(g)⇌2NO(g)△H=+180kJ•mol-1
H2(g)+
O2(g)⇌H2O(l)△H=-285.8kJ•mol-1
则4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=___.
②现将1mol N2(g)、3mol H2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,下列说法中正确的是___.
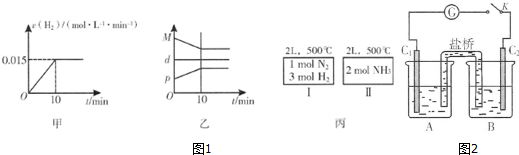
A.图1甲为用H2表示的反应速率变化曲线
B.图1乙表示反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p的变化情况
C.图1丙的两个容器中分别发生反应:N2(g)+3H2(g)⇌2NH3(g)、2NH3(g)⇌N2(g)+3H2(g).达到化学平衡时,相同组分的浓度相等且两个反应的平衡常数互为倒数
(2)反应PCl5(g)⇌PCl3(g)+Cl2(g)△H>0,在2L密闭容器中放人1molPCl5,保持一段时间后达到平衡.反应过程中测定的部分数据见下表:
①若改变温度使v(逆)增大,平衡___移动(填“正向”、“逆向”或“不”);
②该温度下,该反应的平衡常数为___.
(3)①推断As元素在周期表中的位置是___.
②已知某砷酸盐可发生如下反应:AsO43-+2I-+2H+⇌AsO33-+I2+H2O.某化学兴趣小组利用该反应原理设计如图2所示装置:C1、C2是石墨电极,A中盛有KI和I2混合溶液,B中盛有Na3AsO4和Na3AsO3的混合溶液,当连接开关K后,A中溶液颜色逐渐变深,灵敏电流计G的指针向右偏转.此时C2上发生的电极反应式是___;一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针___(填“不动”、“向左偏”或“向右偏”).
(1)氮是地球上含量丰富的一种元素,工业上用N2和H2合成NH3.
①已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ•mol-1
N2(g)+O2(g)⇌2NO(g)△H=+180kJ•mol-1
H2(g)+
| 1 |
| 2 |
则4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=___.
②现将1mol N2(g)、3mol H2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,下列说法中正确的是___.

A.图1甲为用H2表示的反应速率变化曲线
B.图1乙表示反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p的变化情况
C.图1丙的两个容器中分别发生反应:N2(g)+3H2(g)⇌2NH3(g)、2NH3(g)⇌N2(g)+3H2(g).达到化学平衡时,相同组分的浓度相等且两个反应的平衡常数互为倒数
(2)反应PCl5(g)⇌PCl3(g)+Cl2(g)△H>0,在2L密闭容器中放人1molPCl5,保持一段时间后达到平衡.反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
②该温度下,该反应的平衡常数为___.
(3)①推断As元素在周期表中的位置是___.
②已知某砷酸盐可发生如下反应:AsO43-+2I-+2H+⇌AsO33-+I2+H2O.某化学兴趣小组利用该反应原理设计如图2所示装置:C1、C2是石墨电极,A中盛有KI和I2混合溶液,B中盛有Na3AsO4和Na3AsO3的混合溶液,当连接开关K后,A中溶液颜色逐渐变深,灵敏电流计G的指针向右偏转.此时C2上发生的电极反应式是___;一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针___(填“不动”、“向左偏”或“向右偏”).
▼优质解答
答案和解析
(1)①已知:Ⅰ.N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ•mol-1
Ⅱ.N2(g)+O2(g)⇌2NO(g)△H=+180kJ•mol-1
Ⅲ.H2(g)+
O2(g)⇌H2O(l)△H=-285.8kJ•mol-1
根据盖斯定律,Ⅲ×6+Ⅱ×2-Ⅰ×2可得:4NH3(g)+5O2(g)═4NO(g)+6H2O(l),△H=
6×(-285.8kJ•mol-1)+2×180kJ•mol-1-2×(-92.2kJ•mol-1)=-1170.4kJ•mol-1,
故答案为:-1170.4kJ•mol-1;
②A.用H2表示的反应速率为一段时间内平均速率,不是即时速率,而图甲中为即时速率,故A错误;
B.混合气体总质量不变,容器容积不变,混合气体密度为定值,随反应进行混合气体总物质的量减小,则平均相对分子质量减小,至平衡时不再变化,压强也随反应进行减小,至平衡时不再变化,故B错误;
C.丙的两个容器中温度均相同,分别发生反应:N2(g)+3H2(g)⇌2NH3(g)、2NH3(g)⇌N2(g)+3H2(g),两个反应的平衡常数互为倒数,且为完全等效平衡,平衡时相同组分的浓度相等,故C正确,
故选:C;
(2)①正反应为吸热反应,升高温度平衡向正反应移动,故答案为:正向;
②250s处于平衡状态,平衡时PCl3为0.2mol,则:
PCl5(g)⇌PCl3(g)+Cl2(g)
起始量(mol):1 0 0
变化量(mol):0.2 0.2 0.2
平衡量(mol):0.8 0.2 0.2
平衡常数K=
=
=0.025,
故答案为:0.025;
(3)①As处于第四周期VA族,故答案为:第四周期VA族;
②B中滴加浓盐酸时发生AsO43-+2I-+2H+⇌AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为:AsO42-+2H++2e-=AsO32-+H2O,灵敏电流计G的指针向右偏转,说明指针偏向电流流入方向,向B中滴加过量浓NaOH溶液,发生AsO33-+I2+2OH-⇌AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,导线中电流由左向右,可观察到电流计指针向左偏,
故答案为:AsO42-+2H++2e-=AsO32-+H2O;向左偏.
Ⅱ.N2(g)+O2(g)⇌2NO(g)△H=+180kJ•mol-1
Ⅲ.H2(g)+
| 1 |
| 2 |
根据盖斯定律,Ⅲ×6+Ⅱ×2-Ⅰ×2可得:4NH3(g)+5O2(g)═4NO(g)+6H2O(l),△H=
6×(-285.8kJ•mol-1)+2×180kJ•mol-1-2×(-92.2kJ•mol-1)=-1170.4kJ•mol-1,
故答案为:-1170.4kJ•mol-1;
②A.用H2表示的反应速率为一段时间内平均速率,不是即时速率,而图甲中为即时速率,故A错误;
B.混合气体总质量不变,容器容积不变,混合气体密度为定值,随反应进行混合气体总物质的量减小,则平均相对分子质量减小,至平衡时不再变化,压强也随反应进行减小,至平衡时不再变化,故B错误;
C.丙的两个容器中温度均相同,分别发生反应:N2(g)+3H2(g)⇌2NH3(g)、2NH3(g)⇌N2(g)+3H2(g),两个反应的平衡常数互为倒数,且为完全等效平衡,平衡时相同组分的浓度相等,故C正确,
故选:C;
(2)①正反应为吸热反应,升高温度平衡向正反应移动,故答案为:正向;
②250s处于平衡状态,平衡时PCl3为0.2mol,则:
PCl5(g)⇌PCl3(g)+Cl2(g)
起始量(mol):1 0 0
变化量(mol):0.2 0.2 0.2
平衡量(mol):0.8 0.2 0.2
平衡常数K=
| c(PCl3)×c(Cl2) |
| c(PCl5) |
| ||||
|
故答案为:0.025;
(3)①As处于第四周期VA族,故答案为:第四周期VA族;
②B中滴加浓盐酸时发生AsO43-+2I-+2H+⇌AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为:AsO42-+2H++2e-=AsO32-+H2O,灵敏电流计G的指针向右偏转,说明指针偏向电流流入方向,向B中滴加过量浓NaOH溶液,发生AsO33-+I2+2OH-⇌AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,导线中电流由左向右,可观察到电流计指针向左偏,
故答案为:AsO42-+2H++2e-=AsO32-+H2O;向左偏.
看了氮族元素包括氮(N)、磷(P)...的网友还看了以下:
下列关于氮的叙述中不正确的是A.氮气的性质非常稳定,主要是因为氮氮叁键很牢固所致B.氮是氮族中非金 2020-05-13 …
尽管氮元素在地壳中的丰度较低(主要以硝酸盐的形式存在),在所有元素中仅排31位,但是大气中有丰富的 2020-05-14 …
120kg尿素的含氮量相当于多少g碳酸氢铵的含氮量? 2020-05-16 …
计算尿素{CO(NH2)2}和硫酸铵{(NH4)2SO4}中氮元素的质量分数,多少吨硫酸铵的含氮量 2020-05-16 …
连线1.汽车排放尾气①水污染a肺气肿、哮喘2.大量使用农药杀虫②土壤污染b水体富营养化3.使用含氮 2020-06-29 …
氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi):(1)氮是地球上含量丰富的一种元 2020-11-01 …
污水处理中,已知尿素的量怎样计算氨氮的量,1g尿素相当于2g氨氮吗?尿素的化学式为CO(NH2)2, 2020-12-03 …
(1)尿素{CO(NH2)2}中含氮元素的质量分数为多少?(精确到0.1%)(2)60kg尿素含氮元 2021-02-12 …
氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.(1)一定条件下,铁可以和C 2021-02-16 …
尿素是氮肥中最主要的一种,其化学式为CO(NH2)2,试计算:(1)尿素的相对分子质量;(2)尿素中 2021-02-18 …