早教吧作业答案频道 -->化学-->
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出固体是无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用下图所
题目详情
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知 NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出固体是无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用下图所示装置制备亚氯酸钠.
完成下列填空:
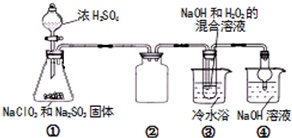
(1)组装好仪器后,检查装置气密性的操作是___.
(2)装置①中用NaClO3、Na2SO3和浓H2SO4反应制得ClO2,写出该反应的化学方程式___,装置③发生反应的离子方程式为___.
(3)装置③反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:
①50℃左右蒸发结晶;
②___;
③用50℃左右的温水洗涤;
④低于60℃干燥,得到成品.
步骤③中用50℃左右的温水洗涤的原因是___.
(4)①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.
②取25.00mL待测液,用2.0mol•L-1Na2S2O3标准液滴定(I2+2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为___.重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为___.
(5)在实验过程中,下列操作会使实验结果偏高的是___
a.读取标准液体积时,开始时平视读数,结束时仰视读数
b.配制250mL待测液时,定容后摇匀发现液面下降,又补加水重新达到刻度线
c.盛装待测液的滴定管注液前未用待测溶液润洗
d.盛装标准液的滴定管尖嘴处滴定前有气泡,滴定终点时气泡消失
(6)已知常温下Ka(HClO2)=1×10-2、Ka(CH3COOH)=1.75×10-5,则0.1mol/L的HClO2溶液与0.05mol/L的NaOH溶液等体积混合所得溶液中各离子浓度由大到小的顺序为___.
完成下列填空:

(1)组装好仪器后,检查装置气密性的操作是___.
(2)装置①中用NaClO3、Na2SO3和浓H2SO4反应制得ClO2,写出该反应的化学方程式___,装置③发生反应的离子方程式为___.
(3)装置③反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:
①50℃左右蒸发结晶;
②___;
③用50℃左右的温水洗涤;
④低于60℃干燥,得到成品.
步骤③中用50℃左右的温水洗涤的原因是___.
| 实验序号 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.00 | 19.96 |
| 2 | 3.26 | 23.30 |
| 3 | 1.10 | 23.40 |
②取25.00mL待测液,用2.0mol•L-1Na2S2O3标准液滴定(I2+2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为___.重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为___.
(5)在实验过程中,下列操作会使实验结果偏高的是___
a.读取标准液体积时,开始时平视读数,结束时仰视读数
b.配制250mL待测液时,定容后摇匀发现液面下降,又补加水重新达到刻度线
c.盛装待测液的滴定管注液前未用待测溶液润洗
d.盛装标准液的滴定管尖嘴处滴定前有气泡,滴定终点时气泡消失
(6)已知常温下Ka(HClO2)=1×10-2、Ka(CH3COOH)=1.75×10-5,则0.1mol/L的HClO2溶液与0.05mol/L的NaOH溶液等体积混合所得溶液中各离子浓度由大到小的顺序为___.
▼优质解答
答案和解析
(1)组装好仪器后,检查整套装置气密性的操作是关闭分液漏斗的玻璃旋塞,将干燥管的末端浸末在水中,微热锥形瓶,干燥管末端有气泡产生,停止加热一段时间后,有回流的液柱,则气密性良好;
故答案为:关闭分液漏斗的玻璃旋塞,将干燥管的末端浸末在水中,微热锥形瓶,干燥管末端有气泡产生,停止加热一段时间后,有回流的液柱,则气密性良好;
(2)在酸性条件下,NaClO3和Na2SO3溶液混合反应生成ClO2、Na2SO4和水,反应为:2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O;装置④反应后获得NaClO2晶体,即ClO2、NaOH和H2O2反应生成NaClO2、H2O和O2,离子方程式为:2ClO2+H2O2+2Na++2OH-+4H2O=2NaClO2•3H2O+O2↑;
故答案为:2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O;2ClO2+H2O2+2Na++2OH-+4H2O=2NaClO2•3H2O+O2↑;
(3)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,所以为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥;
故答案为:趁热过滤;防止产生NaClO2•3H2O晶体;
(4)①以淀粉溶液做指示剂,碘单质遇淀粉变蓝色,反应结束时,碘反应完全,蓝色褪去,达到滴定终点时的现象为当滴加最后一滴Na2S2O3标准液时,溶液由蓝色变为无色且半分钟内不变色;
故答案为:当滴入最后一滴Na2S2O3时,溶液由蓝色变为无色且半分钟内不变色;
②滴定3次,消耗的1Na2S2O3标准液的体积分别为:19.96mL,20.04mL,23.40mL,第3组误差较大,舍去,两次测定的平均值为20.00mL,根据题给反应ClO2-+4I-+4H+=2H2O+2I2+C1-,I2+2S2O32-=2I-+S4O62-得关系式:ClO2-~2I2~4S2O32-,设样品中NaClO2的质量分数为x,则有:
ClO2-~4S2O32-
90.5g 4mol
10.0g•x 2mol•L-1×0.02L×10
解得:x=90.5%
故答案为:90.5%;
(5)a.读取标准液体积时,开始时平视读数,结束时仰视读数,V(标准)偏大,根据c(待测)═
分析,可知c(待测)偏高,故a正确;
b.配制250mL待测液时,定容后摇匀发现液面下降,又补加水重新达到刻度线,溶液体积偏大,根据c=
分析,可知所配制溶液的浓度偏小,故b错误;
c.盛装待测液的滴定管注液前未用待测溶液润洗,待测液浓度偏小,其溶质的物质的量偏小,V(标准)偏小,根据c(待测)═
分析,可知c(待测)偏低,故c错误;
d.盛装标准液的滴定管尖嘴处滴定前有气泡,滴定终点时气泡消失,V(标准)偏大,根据c(待测)═
分析,可知c(待测)偏高,故d正确;
故选:a、d;
(6)0.1mol/L的HClO2溶液与0.05mol/L的NaOH溶液等体积混合,两者反应生成0.025mol/LNaClO2,同时剩余0.025mol/HClO2,等浓度的CH3COOH与CH3COONa的混合溶液,CH3COOH的电离程度大于CH3COO-的水解程度,溶液呈酸性,由Ka(HClO2)=1×10-2,Ka(CH3COOH)=1.75×10-5可知,HClO2的酸性大于醋酸,所以等浓度的HClO2与NaClO2的混合溶液,HClO2的电离程度大于ClO2-离子的水解程度,溶液呈酸性,溶液中离子浓度大小为:c(ClO2-)>c(Na+)>c(H+)>c(OH-);
故答案为:c(ClO2-)>c(Na+)>c(H+)>c(OH-).
故答案为:关闭分液漏斗的玻璃旋塞,将干燥管的末端浸末在水中,微热锥形瓶,干燥管末端有气泡产生,停止加热一段时间后,有回流的液柱,则气密性良好;
(2)在酸性条件下,NaClO3和Na2SO3溶液混合反应生成ClO2、Na2SO4和水,反应为:2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O;装置④反应后获得NaClO2晶体,即ClO2、NaOH和H2O2反应生成NaClO2、H2O和O2,离子方程式为:2ClO2+H2O2+2Na++2OH-+4H2O=2NaClO2•3H2O+O2↑;
故答案为:2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O;2ClO2+H2O2+2Na++2OH-+4H2O=2NaClO2•3H2O+O2↑;
(3)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,所以为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥;
故答案为:趁热过滤;防止产生NaClO2•3H2O晶体;
(4)①以淀粉溶液做指示剂,碘单质遇淀粉变蓝色,反应结束时,碘反应完全,蓝色褪去,达到滴定终点时的现象为当滴加最后一滴Na2S2O3标准液时,溶液由蓝色变为无色且半分钟内不变色;
故答案为:当滴入最后一滴Na2S2O3时,溶液由蓝色变为无色且半分钟内不变色;
②滴定3次,消耗的1Na2S2O3标准液的体积分别为:19.96mL,20.04mL,23.40mL,第3组误差较大,舍去,两次测定的平均值为20.00mL,根据题给反应ClO2-+4I-+4H+=2H2O+2I2+C1-,I2+2S2O32-=2I-+S4O62-得关系式:ClO2-~2I2~4S2O32-,设样品中NaClO2的质量分数为x,则有:
ClO2-~4S2O32-
90.5g 4mol
10.0g•x 2mol•L-1×0.02L×10
解得:x=90.5%
故答案为:90.5%;
(5)a.读取标准液体积时,开始时平视读数,结束时仰视读数,V(标准)偏大,根据c(待测)═
| c(标准)×V(标准) |
| V(待测) |
b.配制250mL待测液时,定容后摇匀发现液面下降,又补加水重新达到刻度线,溶液体积偏大,根据c=
| n |
| V |
c.盛装待测液的滴定管注液前未用待测溶液润洗,待测液浓度偏小,其溶质的物质的量偏小,V(标准)偏小,根据c(待测)═
| c(标准)×V(标准) |
| V(待测) |
d.盛装标准液的滴定管尖嘴处滴定前有气泡,滴定终点时气泡消失,V(标准)偏大,根据c(待测)═
| c(标准)×V(标准) |
| V(待测) |
故选:a、d;
(6)0.1mol/L的HClO2溶液与0.05mol/L的NaOH溶液等体积混合,两者反应生成0.025mol/LNaClO2,同时剩余0.025mol/HClO2,等浓度的CH3COOH与CH3COONa的混合溶液,CH3COOH的电离程度大于CH3COO-的水解程度,溶液呈酸性,由Ka(HClO2)=1×10-2,Ka(CH3COOH)=1.75×10-5可知,HClO2的酸性大于醋酸,所以等浓度的HClO2与NaClO2的混合溶液,HClO2的电离程度大于ClO2-离子的水解程度,溶液呈酸性,溶液中离子浓度大小为:c(ClO2-)>c(Na+)>c(H+)>c(OH-);
故答案为:c(ClO2-)>c(Na+)>c(H+)>c(OH-).
看了亚氯酸钠(NaClO2)是一种...的网友还看了以下:
已知一元二次方程ax2+bx+c=0有一个根是-1.已知一元二次方程ax2+bx+c=0有一个根是 2020-05-16 …
下列各组数中,互为相反数一组是 A|-3|与-3分之1 B|-3|与-(-3) C|-3|与-|- 2020-05-16 …
设直角三角形的两条直角边分别为a,b,斜边是c,周长是C,面积是S,(1)若a=根号50,b=根号 2020-05-17 …
在治安管理处罚中,拘留时间以天为单位,期限一般为( )。A.1日以上,10日以下B.1日以上,15日 2020-05-19 …
一道二项式的题1设A=3^7+C(2,7)·3^5+C(4,7)·3^3+C(6,7)·3,B=C 2020-05-21 …
1.比较2∧100与3∧75的大小2.以知3∧x+1=15∧2x-3,求x的值3.下列计算正确的是 2020-06-06 …
分式方程请观察下列方程和它们的根请观察下列方程和它们的根:x+1/x=c+1/c的解是x=c或x= 2020-06-06 …
想知道这题的做法已知a,b,c是3个正整数,且a>b>c,若a,b,c的算术平均值为14/3,几何 2020-06-13 …
根据下列各式,求x:y的值:(1)3/x=4/y(2)x-y/y=2/3(3)x+y/5=x/2( 2020-07-18 …
条件等式求值~帮忙做一下...1.已知a+b+c=1,a^2+b^2+c^2=2,a^3+b^3+ 2020-07-24 …