早教吧作业答案频道 -->化学-->
实验室用铁粉制备摩尔盐的操作流程如下:(1)流程中“趁热”过滤的原因是.(2)反应1制得硫酸亚铁的物质的量理论上应小于mol.(3)为确定摩尔盐的化学式,进行如下实验:现称
题目详情
实验室用铁粉制备摩尔盐的操作流程如下:
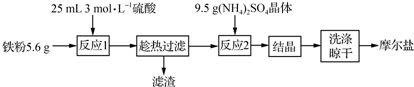
(1)流程中“趁热”过滤的原因是___.
(2)反应1制得硫酸亚铁的物质的量理论上应小于___mol.
(3)为确定摩尔盐的化学式,进行如下实验:现称取4.704g新制摩尔盐,溶于水配制成100.0mL溶液,再将该溶液分成两等份.
向其中一份溶液中加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色,用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体2.796g.
另一份溶液用0.050 0mol•L-1 K2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为20.00mL.
①25℃时,Ksp(BaSO4)=1.1×10-10,若要使溶液中SO42-离子沉淀完全(即该离子浓度须小于1×10-5 mol•L-1),则此时c[(Ba(OH)2]≥___mol•L-1.
②确定该摩尔盐的化学式(写出计算过程).

(1)流程中“趁热”过滤的原因是___.
(2)反应1制得硫酸亚铁的物质的量理论上应小于___mol.
(3)为确定摩尔盐的化学式,进行如下实验:现称取4.704g新制摩尔盐,溶于水配制成100.0mL溶液,再将该溶液分成两等份.
向其中一份溶液中加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色,用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体2.796g.
另一份溶液用0.050 0mol•L-1 K2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为20.00mL.
①25℃时,Ksp(BaSO4)=1.1×10-10,若要使溶液中SO42-离子沉淀完全(即该离子浓度须小于1×10-5 mol•L-1),则此时c[(Ba(OH)2]≥___mol•L-1.
②确定该摩尔盐的化学式(写出计算过程).
▼优质解答
答案和解析
Fe和稀硫酸反应生成硫酸亚铁,趁热过滤,然后想滤液中加入硫酸铵晶体,将溶液结晶、洗涤、晾干得到摩尔盐,
(1)温度越高,硫酸亚铁的溶解度越大,为降低硫酸亚铁的溶解度,需要趁热过滤,
故答案为:防止温度降低,硫酸亚铁晶体析出;
(2)n(Fe)=
=0.1mol,n(H2SO4)=3mol×0.025L=0.075mol,二者反应方程式为Fe+H2SO4=H2↑+FeSO4,根据方程式知,Fe剩余,当硫酸浓度很稀时就不和Fe反应了,所以理论上得到的硫酸亚铁物质的量小于0.075mol,故答案为:0.075;
(3)①25℃时,Ksp(BaSO4)=1.1×10-10,若要使溶液中SO42-离子沉淀完全(即该离子浓度须小于1×10-5 mol•L-1),则c(Ba2+)=
=
mol/L=1.1×10-5mol•L-1,再根据Ba原子守恒得c[(Ba(OH)2]=c(Ba2+)=1.1×10-5mol•L-1,
故答案为:1.1×10-5;
②摩尔盐和氢氧化钡反应生成硫酸钡、氨气、氢氧化亚铁,氢氧化亚铁不稳定,被氧化生成氢氧化铁红褐色沉淀,然后用足量稀盐酸溶解沉淀,最后得到的白色沉淀是BaSO4,n(BaSO4)=
=0.012mol,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n 0.0500mol•L-1×0.020L
n(Fe2+)=0.001 mol×6=0.006mol
根据电荷守恒得n(NH4+)+2n(Fe2+)=2n(SO42-),n(NH4+)=0.012mol,
n(H2O)=
=0.036mol,
n(SO42-):n(Fe2+):n(NH4+):n(H2O)=0 012 mol:0 006 mol:0 012mol:0036 mol=2:1:2:6,故莫尔盐的化学式为:(NH4)2Fe(SO4)2•6H2O[或(NH4)2SO4•FeSO4•6H2O],
故答案为:(NH4)2Fe(SO4)2•6H2O[或(NH4)2SO4•FeSO4•6H2O].
(1)温度越高,硫酸亚铁的溶解度越大,为降低硫酸亚铁的溶解度,需要趁热过滤,
故答案为:防止温度降低,硫酸亚铁晶体析出;
(2)n(Fe)=
| 5.6g |
| 56g/mol |
(3)①25℃时,Ksp(BaSO4)=1.1×10-10,若要使溶液中SO42-离子沉淀完全(即该离子浓度须小于1×10-5 mol•L-1),则c(Ba2+)=
| Ksp(BaSO4) |
| c(SO42-) |
| 1.1×10-10 |
| 10-5 |
故答案为:1.1×10-5;
②摩尔盐和氢氧化钡反应生成硫酸钡、氨气、氢氧化亚铁,氢氧化亚铁不稳定,被氧化生成氢氧化铁红褐色沉淀,然后用足量稀盐酸溶解沉淀,最后得到的白色沉淀是BaSO4,n(BaSO4)=
| 2.796g |
| 233g/mol |
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n 0.0500mol•L-1×0.020L
n(Fe2+)=0.001 mol×6=0.006mol
根据电荷守恒得n(NH4+)+2n(Fe2+)=2n(SO42-),n(NH4+)=0.012mol,
n(H2O)=
| ||
| 18g/mol |
n(SO42-):n(Fe2+):n(NH4+):n(H2O)=0 012 mol:0 006 mol:0 012mol:0036 mol=2:1:2:6,故莫尔盐的化学式为:(NH4)2Fe(SO4)2•6H2O[或(NH4)2SO4•FeSO4•6H2O],
故答案为:(NH4)2Fe(SO4)2•6H2O[或(NH4)2SO4•FeSO4•6H2O].
看了实验室用铁粉制备摩尔盐的操作流...的网友还看了以下:
1.00g某有机化和物A完全燃烧后,得到1.69LCO;气体标准状况)和0.85gH2O,该有机化 2020-05-14 …
甲乙二人同时解方程组:ax+y=3,2x-by=8,甲看错了a解得x=1,y=-1;乙看错了b,解 2020-05-20 …
最好能有过程,1.物体从光滑斜面顶端由静止开始下滑,当它滑到终点时速度为v,经历时间是t,那么这个 2020-05-23 …
阅读下列解方程的过程,并完成(1)、(2)小题的解答.解方程:|x-1|=2当x-1<0,即x<1 2020-07-19 …
1.解方程方程395例:解方程:1/5(X+15)=1/2-1/3(x-7)去分母,得6(X+15 2020-07-22 …
抛物线y=-1/2x^2+3/2x+2与x轴、y轴分别交于A、B、C三点.求得A(-1,0)、B( 2020-07-26 …
先阅读材料,然后解方程组:材料:解方程组:x+13=2y①2(x+1)-y=11②由①得x+1=6 2020-08-01 …
请你试一试,解方程组x+2(x+2y)=4①,x+2y=1②把②代入①得x+2*1=4,所以x=2 2020-08-02 …
阅读下面材料,解方程x/(x-1)-3(x-1)/x=2,设x/(x-1)=y,原方程可化为y-3/ 2020-11-26 …
1,一物体做平抛运动,抛出1s后物体着地,着地时物体速度方向与水平方向成45度角,求:1,物体抛出时 2020-12-05 …