早教吧作业答案频道 -->化学-->
用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、Mg2+、Ca2+、Cu2+等)制备氯化锌的流程如图.离子开始沉淀时的PH完全沉淀时的PHFe3+1.93.2Fe2+7.59.7Zn2+6.48.0
题目详情
用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、Mg2+、Ca2+、Cu2+等)制备氯化锌的流程如图.
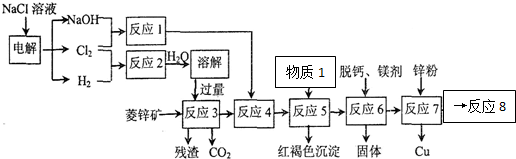
(1)电解饱和食盐水,H2在___极生成
(2)在反应3前要将菱锌矿研磨,其目的是___
(3)反应4的目的:___
(4)物质1最佳选用:___(填符号),调节pH至___(填范围),目的是___
A.NH3•H2O B.NaOH C.ZnO
(5)反应8从溶液中获得ZnCl2,加热前需通入足量的HCl气体,目的___.

| 离子 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.5 | 9.7 |
| Zn2+ | 6.4 | 8.0 |
(2)在反应3前要将菱锌矿研磨,其目的是___
(3)反应4的目的:___
(4)物质1最佳选用:___(填符号),调节pH至___(填范围),目的是___
A.NH3•H2O B.NaOH C.ZnO
(5)反应8从溶液中获得ZnCl2,加热前需通入足量的HCl气体,目的___.
▼优质解答
答案和解析
依据流程分析,反应1是氯气和氢氧化钠溶液反应生成次氯酸钠、氯化钠,反应2是氢气和氯气反应生成氯化氢溶于水得到盐酸,用来溶解菱锌矿,加入次氯酸钠溶液氧化亚铁离子,调节溶液PH加入氧化锌反应生成氢氧化铁沉淀,通过脱钙脱镁得到溶液中含氢离子、铜离子,加入锌反应生成氢气和铜过滤得到氯化锌溶液,电极氯化锌得到氢气和氯气,当浓度达到一定程度可以在阴极析出锌,
(1)电解饱和食盐水,阴极发生还原反应生成氢气,故答案为:阴;
(2)依据影响化学反应速率的因素分析判断,增大接触面积会增大反应速率,以提高浸取率,
故答案为:增大反应物的接触面积,加快反应速率,提高浸取率;
(3)反应4将Fe2+氧化为Fe3+,以便除去铁杂质,故答案为:将Fe2+ 氧化为Fe3+;
(4)为避免引入新杂质,加入氧化锌调节pH,为完全除去铁离子并防止生成氢氧化锌沉淀,调节pH为3.2-6.4,
故答案为:C;3.2-6.4;将Fe3+完全转化为Fe(OH)3除去;
(5)为避免锌离子的水解,防止生成氢氧化锌沉淀,加热溶液时,应通入足量的HCl气体,故答案为:抑制Zn2+(ZnCl2)的水解.
(1)电解饱和食盐水,阴极发生还原反应生成氢气,故答案为:阴;
(2)依据影响化学反应速率的因素分析判断,增大接触面积会增大反应速率,以提高浸取率,
故答案为:增大反应物的接触面积,加快反应速率,提高浸取率;
(3)反应4将Fe2+氧化为Fe3+,以便除去铁杂质,故答案为:将Fe2+ 氧化为Fe3+;
(4)为避免引入新杂质,加入氧化锌调节pH,为完全除去铁离子并防止生成氢氧化锌沉淀,调节pH为3.2-6.4,
故答案为:C;3.2-6.4;将Fe3+完全转化为Fe(OH)3除去;
(5)为避免锌离子的水解,防止生成氢氧化锌沉淀,加热溶液时,应通入足量的HCl气体,故答案为:抑制Zn2+(ZnCl2)的水解.
看了用菱锌矿(主要成分为碳酸锌,还...的网友还看了以下:
H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2 2020-04-06 …
聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚 2020-05-13 …
判断Fe3+、Mn2+、Cr3+能否加速H2O2的分解,如果能请以Fe3+为例分析分解过程.H2O 2020-05-20 …
双水解和生成沉淀Fe3+和碳酸根会双水解,那么溶液中会有碳酸铁沉淀吗?为什么?Fe3+和硫离子就生 2020-05-23 …
要从含Al3+,Fe3+,Ba2+,Ag+的溶液中分别沉淀出Fe3+,Ba2+,Ag+,应按顺序加 2020-06-05 …
FeCl3溶液是实验室中使用比较广泛的一种试剂,下列有关离子方程式正确的是()A.FeCl3溶液使 2020-07-05 …
为什么Fe3+离子加入Na2CO3溶液会产生红褐色沉淀并放出气体?为什么?化学方程式是什么? 2020-07-05 …
(2014•虹口区一模)为使溶液中的3种阳离子A+、B2+、C3+逐一沉淀分离,将含有A+、B2+ 2020-07-09 …
(16分)复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2。(1)H2O2不稳定、 2020-11-07 …
为使Fe2+,Fe3+,Zn2+较完全地形成氢氧化物沉淀,溶液的酸碱度分别为pH7.7、pH4.5、 2020-11-27 …