早教吧作业答案频道 -->化学-->
H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置.(1)若利用甲实验,可通过观察现象,
题目详情
H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置.
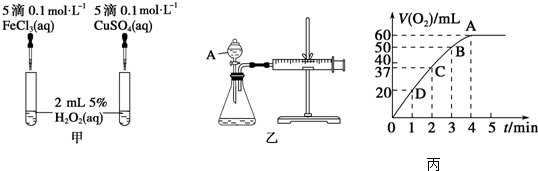
(1)若利用甲实验,可通过观察___现象,从而定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___,若利用乙实验可进行定量分析,图中仪器A的名称为___,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___.
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:___,H2O2初始物质的量浓度为___(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5mol•L-1的硫酸,10s时收集产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为___ mol•L-1•s-1(假设反应前后溶液的体积不变).H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置.

(1)若利用甲实验,可通过观察___现象,从而定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___,若利用乙实验可进行定量分析,图中仪器A的名称为___,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___.
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:___,H2O2初始物质的量浓度为___(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5mol•L-1的硫酸,10s时收集产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为___ mol•L-1•s-1(假设反应前后溶液的体积不变).223+2+3+2+22

324322
22222
-12-1-1

(1)若利用甲实验,可通过观察___现象,从而定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___,若利用乙实验可进行定量分析,图中仪器A的名称为___,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___.
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:___,H2O2初始物质的量浓度为___(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5mol•L-1的硫酸,10s时收集产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为___ mol•L-1•s-1(假设反应前后溶液的体积不变).H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置.

(1)若利用甲实验,可通过观察___现象,从而定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___,若利用乙实验可进行定量分析,图中仪器A的名称为___,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___.
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:___,H2O2初始物质的量浓度为___(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5mol•L-1的硫酸,10s时收集产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为___ mol•L-1•s-1(假设反应前后溶液的体积不变).223+2+3+2+22

324322
22222
-12-1-1
▼优质解答
答案和解析
(1)该反应中产生气体,可根据生成气泡的快慢判断,氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用,硫酸铁和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H22O22
2H2O+O2↑,A仪器名称是分液漏斗;根据v=△c/△t知,还需要测定产生40mL气体所需的时间,
故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;2H2O2
2H2O+O2↑;分液漏斗;产生40mL气体所需的时间;
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2
2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2
2H2O+O2↑,则n(H2O2)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
MnO2 MnO2 MnO2 MnO2 2 2H22O+O22↑,A仪器名称是分液漏斗;根据v=△c/△t知,还需要测定产生40mL气体所需的时间,
故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;2H22O22
2H2O+O2↑;分液漏斗;产生40mL气体所需的时间;
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2
2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2
2H2O+O2↑,则n(H2O2)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
MnO2 MnO2 MnO2 MnO2 2 2H22O+O22↑;分液漏斗;产生40mL气体所需的时间;
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H22O22
2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2
2H2O+O2↑,则n(H2O2)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
MnO2 MnO2 MnO2 MnO2 2 2H22O+O22↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H22O22完全反应放出60 mL O22,H22O22的分解反应为2H22O22
2H2O+O2↑,则n(H2O2)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
MnO2 MnO2 MnO2 MnO2 2 2H22O+O22↑,则n(H22O22)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
0.06L 22.4L/mol 0.06L 0.06L 0.06L22.4L/mol 22.4L/mol 22.4L/mol×2≈0.00536 mol,c(H22O22)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
0.00536mol 0.05L 0.00536mol 0.00536mol 0.00536mol0.05L 0.05L 0.05L≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H22SO44=ZnSO44+H22↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
0.002mol 0.04L×10s 0.002mol 0.002mol 0.002mol0.04L×10s 0.04L×10s 0.04L×10s=0.005mol•L-1-1•s-1-1,
故答案为:0.005.
| ||
故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;2H2O2
| ||
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2
| ||
| ||
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;2H22O22
| ||
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2
| ||
| ||
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H22O22
| ||
| ||
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.
| ||
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H22SO44=ZnSO44+H22↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
看了 H2O2不稳定、易分解,Fe...的网友还看了以下:
在催化剂的作用下,乙炔可被氧化为乙二醛,进一步氧化,乙二醛又转化为乙二酸。某工厂生产乙二酸,每日可 2020-04-11 …
以下属于过氧化物酶体功能的是()。A.把血液中的乙醇氧化成乙醛,起到解毒作用B.先将底物氧化成过氧 2020-05-13 …
过氧乙酸(CH3COOOH)是一种常用消毒剂,下列关于过氧乙酸的叙述正确的是( )A过氧乙酸是一种 2020-05-16 …
重铬酸钾与乙醇反应的问题化学人教版必修二上说,乙醇是直接被氧化成乙酸可必修五上却说,其氧化过程被分 2020-05-17 …
乙醇在肝的线粒体中的化学变化过程?卷子上说乙醇在肝细胞的线粒体中转化为乙酸乙醇先变成乙醛再变成乙酸 2020-05-20 …
关于酒是陈的香酒是陈的香这个原理有解释是乙醇氧化得乙醛,氧化得乙酸,酯化得乙酸乙酯那么1.为什么陈 2020-06-12 …
(2011•南京)如图中的物质都是初中化学所学的,其中A、B为单质,B是可供动植物呼吸的气体;甲、 2020-06-15 …
醛基还原性为什么乙醇被氧化成乙醛时不能继续氧化乙醛呢?不是说醛基的还原性很强,弱氧化剂就可以氧化吗 2020-07-29 …
过氧乙醇和过氧化氢一样不稳定,能分解生成乙醇(化学式为CH3COOOH)和氧气,反应的化过氧乙醇(C 2020-12-20 …
植物精油具有抗菌消炎、解热镇痛之功效.从樟科植物叶中提取的精油中含有甲、乙、丙三种成分.I、甲经下列 2021-01-08 …