早教吧作业答案频道 -->化学-->
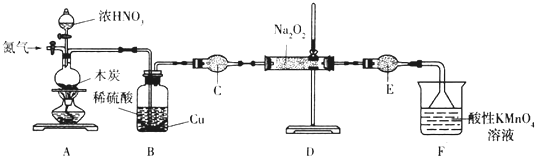
亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备.已知:①2NO+Na2O2═2NaNO2;②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+
题目详情
亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备.
已知:①2NO+Na2O2═2NaNO2;
②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是___.
(2)装置A中发生反应的化学方程式为___.实验结束后,将B瓶中的溶液经蒸发浓缩、___(填操作名称)、过滤可获得CuSO4•5H2O.
(3)仪器C的名称为___,其中盛放的药品为___(填名称).
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,___,则产物是NaNO2(注明试剂、现象).
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
①第一组实验数据出现异常,造成这种异常的原因可能是___(填代号).
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数___.
(6)设计合理实验比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小.(简要说明实验步骤、现象和结论,仪器和药品自选)___.

已知:①2NO+Na2O2═2NaNO2;
②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是___.
(2)装置A中发生反应的化学方程式为___.实验结束后,将B瓶中的溶液经蒸发浓缩、___(填操作名称)、过滤可获得CuSO4•5H2O.
(3)仪器C的名称为___,其中盛放的药品为___(填名称).
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,___,则产物是NaNO2(注明试剂、现象).
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KmnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数___.
(6)设计合理实验比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小.(简要说明实验步骤、现象和结论,仪器和药品自选)___.
▼优质解答
答案和解析
(1)制备亚硝酸钠需要一氧化氮和过氧化钠反应生成,过氧化钠和二氧化碳、水蒸气发生反应,所以制备的一氧化氮气体必须纯净干燥,装置中无空气存在,加热A前,先通一段时间N2,目的是把装置中的空气赶净,避免生成的亚硝酸钠混入杂质,
故答案为:排出装置中的空气;
(2)装置A中发生反应是浓硝酸和碳加热反应生成二氧化碳、二氧化氮和水,反应的化学方程式为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,装置A中生成的二氧化氮进入装置B生成硝酸,氧化铜生成硝酸铜、硫酸铜,蒸发浓缩过程硝酸是易挥发性的酸,所以冷却结晶得到晶体为硫酸铜晶体,
故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;冷却结晶;
(3)制备亚硝酸钠需要一氧化氮和过氧化钠反应生成,过氧化钠和二氧化碳、水蒸气发生反应,所以制备的一氧化氮气体必须纯净干燥,仪器C为干燥管,利用其中的碱石灰用来干燥一氧化氮气体,
故答案为:干燥管;碱石灰;
(4)3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O,反应生成的一氧化氮遇到空气会生成红棕色气体二氧化氮,充分反应后,检验装置D中产物的方法是:取产物少许置于试管中加入稀硫酸溶液中有气泡产生且在试管口上方出现红棕色气体,证明产物是NaNO2,
故答案为:加入稀硫酸溶液中有气泡产生且在试管口上方出现红棕色气体;
(5)①第一组实验数据消耗的酸性高锰酸钾溶液体积偏大,会导致测量结果偏高,
a.酸式滴定管用蒸馏水洗净后未用标准液润洗,导致标准液被稀释,滴定过程中消耗的标准液体积会偏大,故a正确;
b.锥形瓶不需要干燥,所以锥形瓶洗净后未干燥,不影响测定结果,故b错误;
c.滴定终了仰视读数,导致读数偏大,计算出的标准液体积偏大,故c正确;
故答案为:ac;
(6)由于第一组数据偏高,应该舍弃;其它三组消耗标准液平均体积为:
mL=20.00mL,
25mL样品消耗高锰酸钾的物质的量为0.1000mol/L×0.02L=0.002mol,则250mL样品溶液会消耗高锰酸钾的物质的量为0.002mol×
=0.02mol,根据化合价变化可得反应关系式:2MnO4-~5NO2-,则4.000g样品中含有亚硝酸钠的物质的量为0.02mol×
=0.05mol,质量为69g/mol×0.05mol=3.45g,所以反应后的固体中亚硝酸钠的质量分数为:
=100%=86.25%,
故答案为:86.25%;
(6)依据HNO2溶液中存在电离平衡,NO2-存在水解平衡,比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小,实验设计为:25°C将0.1mol/LHNO2和0.1mol/LNaNO2溶液等体积混合,若测定溶液PH<7,说明HNO2的电离程度大于NO2-离子的水解程度,若测定溶液pH>7,说明NO2-离子水解程度大于HNO2的电离程度,
故答案为:25°C将0.1mol/LHNO2和0.1mol/LNaNO2溶液等体积混合,若测定溶液PH<7,说明HNO2的电离程度大于NO2-离子的水解程度,若测定溶液pH>7,说明NO2-离子水解程度大于HNO2的电离程度.
故答案为:排出装置中的空气;
(2)装置A中发生反应是浓硝酸和碳加热反应生成二氧化碳、二氧化氮和水,反应的化学方程式为:C+4HNO3(浓)
| ||
故答案为:C+4HNO3(浓)
| ||
(3)制备亚硝酸钠需要一氧化氮和过氧化钠反应生成,过氧化钠和二氧化碳、水蒸气发生反应,所以制备的一氧化氮气体必须纯净干燥,仪器C为干燥管,利用其中的碱石灰用来干燥一氧化氮气体,
故答案为:干燥管;碱石灰;
(4)3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O,反应生成的一氧化氮遇到空气会生成红棕色气体二氧化氮,充分反应后,检验装置D中产物的方法是:取产物少许置于试管中加入稀硫酸溶液中有气泡产生且在试管口上方出现红棕色气体,证明产物是NaNO2,
故答案为:加入稀硫酸溶液中有气泡产生且在试管口上方出现红棕色气体;
(5)①第一组实验数据消耗的酸性高锰酸钾溶液体积偏大,会导致测量结果偏高,
a.酸式滴定管用蒸馏水洗净后未用标准液润洗,导致标准液被稀释,滴定过程中消耗的标准液体积会偏大,故a正确;
b.锥形瓶不需要干燥,所以锥形瓶洗净后未干燥,不影响测定结果,故b错误;
c.滴定终了仰视读数,导致读数偏大,计算出的标准液体积偏大,故c正确;
故答案为:ac;
(6)由于第一组数据偏高,应该舍弃;其它三组消耗标准液平均体积为:
| 20.2+20.00+19.98 |
| 3 |
25mL样品消耗高锰酸钾的物质的量为0.1000mol/L×0.02L=0.002mol,则250mL样品溶液会消耗高锰酸钾的物质的量为0.002mol×
| 250mL |
| 25mL |
| 5 |
| 2 |
| 3.45g |
| 4.000g |
故答案为:86.25%;
(6)依据HNO2溶液中存在电离平衡,NO2-存在水解平衡,比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小,实验设计为:25°C将0.1mol/LHNO2和0.1mol/LNaNO2溶液等体积混合,若测定溶液PH<7,说明HNO2的电离程度大于NO2-离子的水解程度,若测定溶液pH>7,说明NO2-离子水解程度大于HNO2的电离程度,
故答案为:25°C将0.1mol/LHNO2和0.1mol/LNaNO2溶液等体积混合,若测定溶液PH<7,说明HNO2的电离程度大于NO2-离子的水解程度,若测定溶液pH>7,说明NO2-离子水解程度大于HNO2的电离程度.
看了亚硝酸钠(NaNO2)是一种工...的网友还看了以下:
1*2+2*3=1*(2*3)/3+3*(2*3)/3=2*3*4/31*2+2*3+3*4=2* 2020-05-13 …
用O,2,3,4,5组成三位数X两位数用O,2,3,4,5能写出多少个三位数乘两位数的算式 2020-05-13 …
在空间直角坐标系下,点A(2,3,-4)关于xoy面、O(0,0,0)、x轴的对称点分别为A:(2 2020-06-03 …
设x,y都是有理数,且满足方程(1/2+π/3)x+(1/3+π/2)y-4-π=o,求x,y的值 2020-06-14 …
弧,玄,圆心角题(1)圆O中,玄AB=3,圆心角AOB=120,则圆O的半径是?(2)A,B,C, 2020-07-02 …
一位同学发现:o×1×2×3+1=1=1^21×2×3×4+1=25=5^22×3×4×5+1=1 2020-07-17 …
求给以下算法复杂度排序增长速度由慢到快1)O(n^(3/4))O(log(n)^5)O(2^n)O 2020-07-23 …
在极坐标系中,已知点A(-2,-∏/2),B(√2,3∏/4)O(0,0),则三角形ABO为注:∏ 2020-08-02 …
1+2+3+4+5+6+7+8+9+10+11+12+13+14+15×0=?求大神告知^1+2+3 2020-11-27 …
想一想,挑选卡片中的数填空.卡片有:4/5,7/8,2/3,4两数的积小于1:口O口=口(方块里填数 2020-12-23 …