早教吧作业答案频道 -->化学-->
以化学反应原理为依据,以实验室研究为基础,可以实验许多化工生产Ⅰ.分解水制氢气的工业制法之一是“硫-碘循环法”,主要涉及下列反应:①SO2+2H2O+I2=H2SO4+2HI②2HI⇌H2+I2③2H2SO4=2SO2+O2
题目详情
以化学反应原理为依据,以实验室研究为基础,可以实验许多化工生产
Ⅰ.分解水制氢气的工业制法之一是“硫-碘循环法”,主要涉及下列反应:
①SO2+2H2O+I2=H2SO4+2HI ②2HI⇌H2+I2 ③2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是___
a.循环过程中产生1molO2的同时产生1molH2
b.反应①中SO2还原性比HI强
c.循环过程中需补充H2O
d.反应③易在常温下进行
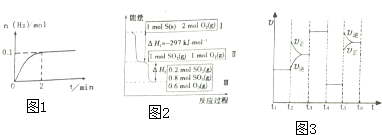
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应②,H2物质的量随时间的变化如图1所示,0-2min内的平均反应速率v(HI)=___;HI的转化率=___
(3)恒温恒容条件下,硫发生转化的反应过程和能量关系如图2所示.请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式___
②恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值比|△H2|___(填“大”、“小”或“相等”)
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,工业上可由石英与焦炭的高温的氮气流中,通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g)⇌Si3N4(s)+6CO(g)△H<0
(1)该反应平衡常数的表达式为K=___,升高温度,其平衡常数___(填“增大”、“减少”或“不变”)
(2)该化学反应速率与反应时间的关系如图3所示,t2时引起v正突变的原因是___,t3引起变化的因素为___,t5时引起v正小变化、v逆大变化的原因是___
Ⅰ.分解水制氢气的工业制法之一是“硫-碘循环法”,主要涉及下列反应:
①SO2+2H2O+I2=H2SO4+2HI ②2HI⇌H2+I2 ③2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是___
a.循环过程中产生1molO2的同时产生1molH2
b.反应①中SO2还原性比HI强
c.循环过程中需补充H2O
d.反应③易在常温下进行
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应②,H2物质的量随时间的变化如图1所示,0-2min内的平均反应速率v(HI)=___;HI的转化率=___
(3)恒温恒容条件下,硫发生转化的反应过程和能量关系如图2所示.请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式___
②恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值比|△H2|___(填“大”、“小”或“相等”)
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,工业上可由石英与焦炭的高温的氮气流中,通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g)⇌Si3N4(s)+6CO(g)△H<0
(1)该反应平衡常数的表达式为K=___,升高温度,其平衡常数___(填“增大”、“减少”或“不变”)
(2)该化学反应速率与反应时间的关系如图3所示,t2时引起v正突变的原因是___,t3引起变化的因素为___,t5时引起v正小变化、v逆大变化的原因是___

▼优质解答
答案和解析
I.(1)a.由③可知产生lmolO2的同时产生2molSO2,由①可知2molSO2生成4molHI,由②可知4molHI分解生成2mol H2,故循环过程中产生1molO2的同时产生2molH2,故a错误;
b.反应中二氧化硫表现还原性,HI为还原产物,还原剂还原性强于还原产物的还原性,故b正确;
c.反应①中1molSO2消耗2molH2O生成1molH2SO4,反应③中1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.硫酸常温下温度,不易分解,故d错误,
故答案为:bc;
(2)由图可知,2min内氢气的物质的量增加了0.1mol,体积为2L,故v(H2)=
=0.025mol/L,则v(HI)=2v(H2)=0.025mol/(L.min)×2=0.05mol/(L.min);
参加反应的HI为0.1mol×2=0.2mol,故HI的转化率为
×100%=20%,
故答案为:0.05mol/(L.min);20%;
(3)①燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,由图1可知1molS(s)完全燃烧放出的热量为297KJ,所以硫的燃烧热的热化学方程式为:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1,
故答案为:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1;
②恒温恒容时,1molSO2和2molO2充分反应,到达的平衡状态,相当于在Ⅱ平衡的基础上再加入1molO2,平衡向正反应方向移动,平衡时放出的热量较Ⅱ到达平衡时放出的热量多,即恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值比|△H2|大,
故答案为:大;
Ⅱ.(1)可逆反应:3SiO2(s)+6C(s)+2N2(g)⇌Si3N4(s)+6CO(g)△H<0,其平衡常数表达式K=
,正反应为放热反应,升高温度,平衡向逆反应分析移动,平衡常数减小,
故答案为:
;减小;
(2)t2时瞬间,v正增大、v逆不变,应是增大反应物浓度,即增大氮气的浓度;
t3时刻,平衡未移动,正逆反应速率同等程度增大,而两边气体的化学计量数不等,故不是增大压强,应是加入催化剂;
t5时引起v逆、v正都变大,但v逆>v正平衡逆向移动,正反应为气体体积增大的放热反应,可能是升高温度或增大压强(或缩小容器体积),
故答案为:增大了氮气的浓度;加入催化剂;升高温度或增大压强(或缩小容器体积).
b.反应中二氧化硫表现还原性,HI为还原产物,还原剂还原性强于还原产物的还原性,故b正确;
c.反应①中1molSO2消耗2molH2O生成1molH2SO4,反应③中1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.硫酸常温下温度,不易分解,故d错误,
故答案为:bc;
(2)由图可知,2min内氢气的物质的量增加了0.1mol,体积为2L,故v(H2)=
| ||
| 2min |
参加反应的HI为0.1mol×2=0.2mol,故HI的转化率为
| 0.2mol |
| 1mol |
故答案为:0.05mol/(L.min);20%;
(3)①燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,由图1可知1molS(s)完全燃烧放出的热量为297KJ,所以硫的燃烧热的热化学方程式为:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1,
故答案为:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1;
②恒温恒容时,1molSO2和2molO2充分反应,到达的平衡状态,相当于在Ⅱ平衡的基础上再加入1molO2,平衡向正反应方向移动,平衡时放出的热量较Ⅱ到达平衡时放出的热量多,即恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值比|△H2|大,
故答案为:大;
Ⅱ.(1)可逆反应:3SiO2(s)+6C(s)+2N2(g)⇌Si3N4(s)+6CO(g)△H<0,其平衡常数表达式K=
| c6(CO) |
| c2(N2) |
故答案为:
| c6(CO) |
| c2(N2) |
(2)t2时瞬间,v正增大、v逆不变,应是增大反应物浓度,即增大氮气的浓度;
t3时刻,平衡未移动,正逆反应速率同等程度增大,而两边气体的化学计量数不等,故不是增大压强,应是加入催化剂;
t5时引起v逆、v正都变大,但v逆>v正平衡逆向移动,正反应为气体体积增大的放热反应,可能是升高温度或增大压强(或缩小容器体积),
故答案为:增大了氮气的浓度;加入催化剂;升高温度或增大压强(或缩小容器体积).
看了以化学反应原理为依据,以实验室...的网友还看了以下:
一道简单的二阶导数和一道简单的不定积分1,设f"(x)存在,证明lim(h->0)[f(x0+h) 2020-05-13 …
一个mathematica程序添加作图语句Clear[x,y,n,h,S1,S2,S3,S4,i] 2020-05-16 …
水景泵(品牌:熊猫)规格是Q=25m3/h,H=10m,P=2.2kwQ=16m3/h,H=10m 2020-05-17 …
1人工装6H完成一半后,机器和人工装H再完成一半后如机器单独装XH可以完成后一半.设X,找出数量关 2020-06-14 …
设X={1,2,3},G为由X的全体置换组成的群S3,取H={(1),(1,2)},则(1)H=? 2020-06-23 …
有一把“220V25W”的电烙铁,正常工作半小时,它消耗的电能是kW•h,1kW•h的电能可供它正 2020-06-29 …
已知弦长弓高,求半径,请给出多种解法和公式,需求简单快速的解答办法A到B是80,高20、求半径.给 2020-07-08 …
某电能表表盘上标有“3000r/kW•h”,用该电能表和手表来测算某电灯的电功率,发现转盘转15转 2020-07-20 …
f(x)=sinx,求f(1+h),[f(1+h)-f(1)]/h根据和差化积公式:sinα-si 2020-08-02 …
胡运权运筹学习题集排队论一道题工件按普阿松流到达某加工设备,λ=20个/h,据测算该设备每多加工一个 2020-12-13 …