早教吧作业答案频道 -->化学-->
氯及其化合物在生产、生活中有广泛的用途.回答下列问题:(1)“氯氧化法”是指在碱性条件下用Cl2将废水中的CN-氧化成无毒物质.写出该反应的离子方程式:.(2)地康法制备氯气
题目详情
氯及其化合物在生产、生活中有广泛的用途.回答下列问题:
(1)“氯氧化法”是指在碱性条件下用Cl2将废水中的CN-氧化成无毒物质.写出该反应的离子方程式:___.
(2)地康法制备氯气的反应为4HCl(g)+O2(g)
2Cl2(g)+2H2O(g)△H=-115.6kJ•mol-1,1molH-Cl、1molCl-Cl、1molO-O断裂时分别需要吸收431J、243kJ、489kJ的能量,则1molO-H断裂时需吸收的能量为___kJ.
(3)取ClO2消毒过的自来水(假定ClO2全部转化为Cl-)30.00mL,在水样中加入几滴K2CrO4溶液作指示剂,用一定浓度AgNO3溶液滴定,当有砖红色的Ag2CrO4沉淀出现时,反应达到滴定终点,测得溶液中CrO42-的浓度是5.00×10-3mol•L-1,则滴定终点时溶液中c(Cl-)=___.[已知:Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12]
(4)在5个恒温、恒容密闭容器中分别充入4molClO2(g),发生反应:4ClO2)(g)⇌2Cl2O(g)+3O2(g)△H>0,测得ClO2(g)的部分平衡转化率如表所示.
已知:T3>T1,V2>V1.
①该反应中Cl2O是___(填“还原产物”或“氧化产物”).
②T1℃时,上述反应的平衡常数K=___.
③V2___(填“>”、“<”或“=”)V3.
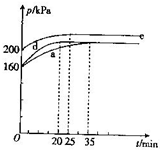
④d、c两容器中的反应与a容器中的反应均各有一个条件不同,a、d、e三容器中反应体系总压强随时间的变化如图所示,a、d、e三容器中ClO2的平衡转化率由大到小的排列顺序为___(用字母表示);与a容器相比,d容器中改变的一个实验条件是___,其判断依据是___.

(1)“氯氧化法”是指在碱性条件下用Cl2将废水中的CN-氧化成无毒物质.写出该反应的离子方程式:___.
(2)地康法制备氯气的反应为4HCl(g)+O2(g)
| ||
| 400℃ |
(3)取ClO2消毒过的自来水(假定ClO2全部转化为Cl-)30.00mL,在水样中加入几滴K2CrO4溶液作指示剂,用一定浓度AgNO3溶液滴定,当有砖红色的Ag2CrO4沉淀出现时,反应达到滴定终点,测得溶液中CrO42-的浓度是5.00×10-3mol•L-1,则滴定终点时溶液中c(Cl-)=___.[已知:Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12]
(4)在5个恒温、恒容密闭容器中分别充入4molClO2(g),发生反应:4ClO2)(g)⇌2Cl2O(g)+3O2(g)△H>0,测得ClO2(g)的部分平衡转化率如表所示.
| 容器编号 | 温度/ | 容器体积/L | ClO2(g)的平衡转化率 |
| a | T1 | V1=1L | 75% |
| b | T2 | V2 | |
| c | T3 | V3 | 75% |
| d | |||
| e |
①该反应中Cl2O是___(填“还原产物”或“氧化产物”).
②T1℃时,上述反应的平衡常数K=___.
③V2___(填“>”、“<”或“=”)V3.
④d、c两容器中的反应与a容器中的反应均各有一个条件不同,a、d、e三容器中反应体系总压强随时间的变化如图所示,a、d、e三容器中ClO2的平衡转化率由大到小的排列顺序为___(用字母表示);与a容器相比,d容器中改变的一个实验条件是___,其判断依据是___.
▼优质解答
答案和解析
(1)根据已知信息:Cl2将废水中的CN-氧化成无毒的N2和CO2,离子方程式为:5Cl2+2CN-+8OH-═10Cl-+N2↑+2CO2↑+4H2O,
故答案为:5Cl2+2CN-+8OH-═10Cl-+N2↑+2CO2↑+4H2O;
(2)地康法制备氯气的反应为4HCl(g)+O2(g)
2Cl2(g)+2H2O(g)△H=-115.6kJ•mol-1,1molH-Cl、1molCl-Cl、1molO-O断裂时分别需要吸收431J、243kJ、489kJ的能量,则1molO-H断裂时需吸收的能量为x,
则△H=4×431J+489kJ-2×243kJ-2×2×x=-115.6kJ•mol-1,x=460.65KJ,
故答案为:460.65KJ;
(3)在水样中加入几滴K2CrO4溶液作指示剂,用一定浓度AgNO3溶液滴定,当有砖红色的Ag2CrO4沉淀出现时,反应达到滴定终点,测得溶液中CrO42-的浓度是5.00×10-3mol•L-1,结合Ksp(Ag2CrO4)=2.00×10-12计算银离子浓度c2(Ag+)=
(mol/L)2,c(Ag+)=2×10-5mol/L,则滴定终点时溶液中c(Cl-)=
=8.90×10-6mol/L,
故答案为:8.90×10-6mol/L;
(4)①ClO2(g),4ClO2)(g)⇌2Cl2O(g)+3O2(g),反应中氯元素化合价+4价变化为+2价,化合价降低做氧化剂被还原,则该反应中Cl2O是还原产物,
故答案为:还原产物;
②恒温、恒容密闭容器中充入4mol,T1时ClO2(g)的平衡转化率为75%,V1=1L,
4ClO2(g)⇌2Cl2O(g)+3O2(g),
起始量(mol/L) 4 0 0
变化量(mol/L) 4×75% 1.5 2.25
平衡量(mol/L) 1 1.5 2.25
K=
=25.63,
故答案为:25.63;
③已知:T3>T1,V2>V1.T1、T3状态下ClO2(g)的平衡转化率相同为相同平衡状态,反应为吸热反应,升温平衡正向进行,则V2>V3,
故答案为:>;
④d、c两容器中的反应与a容器中的反应均各有一个条件不同,a、d、e三容器中反应体系总压强随时间的变化如图所示,ad最后达到相同平衡状态,d达到平衡时间缩短,但最后压强相同,说明d是加入催化剂,改变反应速率不改变化学平衡,e状态下压强大,增大压强平衡逆向进行,转化率减小,a、d、e三容器中ClO2的平衡转化率由大到小的排列顺序为:e<a=d,
故答案为:e<a=d;加入催化剂;ad图象中曲线变化可知,d反应速率增大,压强不变平衡点不变;
故答案为:5Cl2+2CN-+8OH-═10Cl-+N2↑+2CO2↑+4H2O;
(2)地康法制备氯气的反应为4HCl(g)+O2(g)
| ||
| 400℃ |
则△H=4×431J+489kJ-2×243kJ-2×2×x=-115.6kJ•mol-1,x=460.65KJ,
故答案为:460.65KJ;
(3)在水样中加入几滴K2CrO4溶液作指示剂,用一定浓度AgNO3溶液滴定,当有砖红色的Ag2CrO4沉淀出现时,反应达到滴定终点,测得溶液中CrO42-的浓度是5.00×10-3mol•L-1,结合Ksp(Ag2CrO4)=2.00×10-12计算银离子浓度c2(Ag+)=
| 2.00×10-12 |
| 5.00×10-3 |
| 1.78×10-10 |
| 2×10-5 |
故答案为:8.90×10-6mol/L;
(4)①ClO2(g),4ClO2)(g)⇌2Cl2O(g)+3O2(g),反应中氯元素化合价+4价变化为+2价,化合价降低做氧化剂被还原,则该反应中Cl2O是还原产物,
故答案为:还原产物;
②恒温、恒容密闭容器中充入4mol,T1时ClO2(g)的平衡转化率为75%,V1=1L,
4ClO2(g)⇌2Cl2O(g)+3O2(g),
起始量(mol/L) 4 0 0
变化量(mol/L) 4×75% 1.5 2.25
平衡量(mol/L) 1 1.5 2.25
K=
| 2.253×1.52 |
| 14 |
故答案为:25.63;
③已知:T3>T1,V2>V1.T1、T3状态下ClO2(g)的平衡转化率相同为相同平衡状态,反应为吸热反应,升温平衡正向进行,则V2>V3,
故答案为:>;
④d、c两容器中的反应与a容器中的反应均各有一个条件不同,a、d、e三容器中反应体系总压强随时间的变化如图所示,ad最后达到相同平衡状态,d达到平衡时间缩短,但最后压强相同,说明d是加入催化剂,改变反应速率不改变化学平衡,e状态下压强大,增大压强平衡逆向进行,转化率减小,a、d、e三容器中ClO2的平衡转化率由大到小的排列顺序为:e<a=d,
故答案为:e<a=d;加入催化剂;ad图象中曲线变化可知,d反应速率增大,压强不变平衡点不变;
看了 氯及其化合物在生产、生活中有...的网友还看了以下:
已知:氢气与氧气,氢气与氯气都可以点燃化合.同样反应条件,已知:氢气与氧气,氢气与氯气都可以点燃化 2020-05-17 …
有表面被氧化的镁条8.8克,与100克29.4%的稀硫酸刚好完全反应有表面被氧化的镁条8.8克,与 2020-06-03 …
四氧化三铁和一氧化碳怎么反应.四氧化三铁和一氧化碳怎么反应?反应条件是高温还是加热。要官方出处、用 2020-06-10 …
写出下列反应的化学方程式.1.焦炭与过量空气在高温的反应条件下生成二氧化碳.2.二氧化碳与焦炭在高 2020-06-24 …
(1)根据生物对氧气的需求判定,酵母菌是微生物;写出酵母菌在有氧条件进行有氧呼吸的反应式:;在无氧 2020-06-26 …
控制反应的条件,磷和氧气的反应在A、B两个容器中分别控制不同条件按如下两种形式进行反应磷和氧气的反 2020-07-02 …
控制反应的条件,磷和氧气的反应在A、B两个容器中分别控制不同条件按如下两种形式进行反应磷和氧气的反 2020-07-02 …
化学问题-关于氧化还原反应1.反应速度越快,说明还原性(氧化性)越强?2.失电子越多,还原性越弱?3 2020-11-02 …
氮气发生氧化反应的条件是什么?没有温和的室温下的反应条件了吗?传统的微生物固氮是在温和条件下的还原反 2020-11-20 …
某学生做镁条燃烧的实验:反应开始坩埚净重ag,镁条和坩埚共bg,反应结束后,氧化镁和坩埚共重cg,则 2020-12-17 …