早教吧作业答案频道 -->化学-->
硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.(1)基态铁原子的外围电子层排布为
题目详情
硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.
(1)基态铁原子的外围电子层排布为___,该元素位于元素周期表中的第___族,在水溶液中常以Fe2+、Fe3+的形式存在,其中___更稳定.
(2)以硼酸为原料可制得NaBH4,B原子的杂化方式为___.
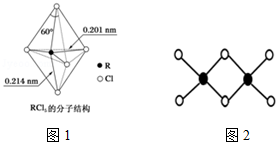
(3)第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图1所示,下列关于RCl5分子的说法中不正确的是___
A.分子中5个R-Cl键键能不都相同
B.键角(Cl-R-Cl)有90°、120、180°几种
C.RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D.每个原子都达到8电子稳定结构
(4)因为氯化铝易升华,其双聚物Al2Cl6结构如图2所示.1mol该分子中含___个配位键,该分子___(填“是”或“否”)平面型分子.
(5)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是___.
(6)二硫化碳属于___ (填“极性”或“非极性”)分子.

(1)基态铁原子的外围电子层排布为___,该元素位于元素周期表中的第___族,在水溶液中常以Fe2+、Fe3+的形式存在,其中___更稳定.
(2)以硼酸为原料可制得NaBH4,B原子的杂化方式为___.
(3)第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图1所示,下列关于RCl5分子的说法中不正确的是___
A.分子中5个R-Cl键键能不都相同
B.键角(Cl-R-Cl)有90°、120、180°几种
C.RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D.每个原子都达到8电子稳定结构
(4)因为氯化铝易升华,其双聚物Al2Cl6结构如图2所示.1mol该分子中含___个配位键,该分子___(填“是”或“否”)平面型分子.
(5)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是___.
(6)二硫化碳属于___ (填“极性”或“非极性”)分子.
▼优质解答
答案和解析
(1)Fe元素原子核外电子数为26,根据能量最低原理,其价电子排布式为3d64s2,在周期表中位于第Ⅷ族,Fe3+离子3d为半满稳定状态,能量较低,比较稳定;
故答案为:3d64s2;Ⅷ;Fe3+;
(2)NaBH4中B原子价层电子对数为4+
=4,杂化轨道数目为4,其杂化方式为:sp3,
故答案为:sp3;
(3)A.键长越短,键能越大,键长不同,所以键能不同,故A正确;
B.上下两个顶点与中心R原子形成的键角为180°,中间为平面三角形,构成三角形的键角为120°,顶点与平面形成的键角为90°,所以键角(Cl-R-Cl)有90°、120、180°几种,故B正确;
C.RCl5
RCl3+Cl2↑,则RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3,故C正确;
D.R原子最外层有5个电子,形成5个共用电子对,所以RCl5中R的最外层电子数为10,不满足8电子稳定结构,故D错误;
故答案为:D;
(4)Al2Cl6结构中黑色球为Al原子、白色球为Cl原子,Al原子与Cl原子之间形成3个共价键、1个配位键,Al原子杂化轨道数目为4,1mol该分子中含2NA个配位键,该分子不是平面型分子,
故答案为:2NA;否;
(5)分子间中如果含有氢键,会导致其沸点升高,
故答案为:HN3分子间存在氢键;
(6)二硫化碳属于直线型分子,结构对称,属于非极性分子,
故答案为:非极性.
故答案为:3d64s2;Ⅷ;Fe3+;
(2)NaBH4中B原子价层电子对数为4+
| 3+1-1×4 |
| 2 |
故答案为:sp3;
(3)A.键长越短,键能越大,键长不同,所以键能不同,故A正确;
B.上下两个顶点与中心R原子形成的键角为180°,中间为平面三角形,构成三角形的键角为120°,顶点与平面形成的键角为90°,所以键角(Cl-R-Cl)有90°、120、180°几种,故B正确;
C.RCl5
| ||
D.R原子最外层有5个电子,形成5个共用电子对,所以RCl5中R的最外层电子数为10,不满足8电子稳定结构,故D错误;
故答案为:D;
(4)Al2Cl6结构中黑色球为Al原子、白色球为Cl原子,Al原子与Cl原子之间形成3个共价键、1个配位键,Al原子杂化轨道数目为4,1mol该分子中含2NA个配位键,该分子不是平面型分子,
故答案为:2NA;否;
(5)分子间中如果含有氢键,会导致其沸点升高,
故答案为:HN3分子间存在氢键;
(6)二硫化碳属于直线型分子,结构对称,属于非极性分子,
故答案为:非极性.
看了 硼及其化合物在工业上有许多用...的网友还看了以下:
PM2.5是指大气中直径小于或等于2.5μm(1μm=0.000001m)的颗粒物,对人体健康及大 2020-05-13 …
PM2.5是指大气中直径小于或等于2.5μm(1μm=0.000001m)的颗粒物,也称为可入肺颗 2020-05-13 …
PM2.5是指大气中直径小于或等于2.5μm(1μm=0.000001m)的颗粒物,也称为可入肺颗 2020-05-13 …
Co3+的八面体配合物为CoClm•nNH3,若1mol此配合物与AgNO3作用生成1molAgC 2020-05-13 …
在平面直角坐标系中,已知抛物线经过点A(0,4)B(1,0)C(5,0)抛物线对称轴与X轴交于M. 2020-05-16 …
1、抛物线y=2x^2+8+m与x轴只有一个交点,m值为?2、一直抛物线y=ax^2+bx+c经过 2020-06-14 …
两个人要将质量为M="1000"kg的货物装进离地高h="1"m的卡车车厢内,他们找到了一个长为L 2020-07-21 …
(2014•莆田)如图为空气成分示意图.即将实施的《环境空气质量标准》中,农村地区PM2.5和PM1 2020-11-12 …
1、某化合物化学式为HnMO2n已知在该化合物中M的化合价为+6,则n的值为()2、X、Y、Z三种元 2020-12-31 …
PM2.5是雾霾中直径小于或等于2.5μm的颗粒物,容易被吸入人的肺部,下列关于PM2.5颗粒物直径 2021-02-05 …