早教吧作业答案频道 -->化学-->
锂离子电池的广泛应用使得锂电池的回收利用一直是科学家关注的焦点.磷酸铁锂则是锂电池中最有前景的正极材料,磷酸铁是其前驱体,充放电时可以实现相互转化.某研究性小组对废旧
题目详情
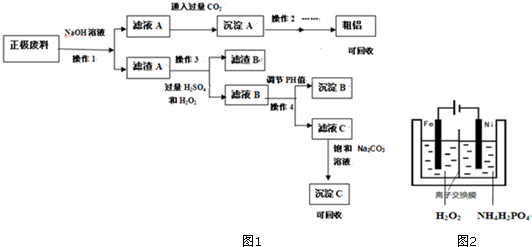
锂离子电池的广泛应用使得锂电池的回收利用一直是科学家关注的焦点.磷酸铁锂则是锂电池中最有前景的正极材料,磷酸铁是其前驱体,充放电时可以实现相互转化.某研究性小组对废旧锂离子电池正极材料(图中简称废料,成份为LiFePO4、碳粉和铝箔)进行金属资源回收研究,设计实验流程如图1:
已知:①FePO4可溶于稀H2SO4,不溶于水和其他的酸.
②Li2SO4、LiOH和Li2CO3在273K下的溶解度分别为34.2g、22.7g和1.54g373K下,Li2CO3的溶解度为
0.72g
③Ksp[Al(OH)3]=10-32Ksp[Fe(OH)3]=4×10-38
(1)可以提高操作1浸出率的方法有(写出3种)___
(2)完成操作3中的离子方程式:___
(3)该锂电池充电时的正极反应式:___
(4)操作4中应选择试剂___将溶液调节pH值至___.
(5)沉淀C的成分___
(6)磷酸铁也可以通过电解法制备,如右图2,请完成制备过程的总反应离子方程式:___
已知:①FePO4可溶于稀H2SO4,不溶于水和其他的酸.
②Li2SO4、LiOH和Li2CO3在273K下的溶解度分别为34.2g、22.7g和1.54g373K下,Li2CO3的溶解度为
0.72g
③Ksp[Al(OH)3]=10-32Ksp[Fe(OH)3]=4×10-38
(1)可以提高操作1浸出率的方法有(写出3种)___
(2)完成操作3中的离子方程式:___
(3)该锂电池充电时的正极反应式:___
(4)操作4中应选择试剂___将溶液调节pH值至___.
(5)沉淀C的成分___
(6)磷酸铁也可以通过电解法制备,如右图2,请完成制备过程的总反应离子方程式:___

▼优质解答
答案和解析
锂离子电池正极材料(成份为LiFePO4、碳粉和铝箔)氢氧化钠溶液溶解,过滤得滤渣A中含有LiFePO4、碳粉,滤液A中含有四羟基合铝酸钠,滤液A中通入二氧化碳得沉淀A为氢氧化铝,氢氧化铝经过灼烧分解、电解可得铝,滤渣A中加入双氧水、硫酸,过滤得滤渣B为碳粉,滤液B的主要成分为Fe3+、Li+、PO43-,调节滤液B的PH值,过滤,可得沉淀B为氢氧化铁,滤液C中含有Li+、PO43-,滤液C中加入碳酸钠可得沉淀C为Li2CO3,
(1)根据影响反应速率的因素可知,提高操作1浸出率的方法有升温,搅拌,增大浓度,增加时间等,
故答案为:升温,搅拌,增大浓度,增加时间等;
(2)操作3中加入双氧水,将亚铁离子氧化成铁离子,反应的离子方程式为:2LiFePO4+H2O2+2H+=2Fe3++2Li++2PO43-+2H2O,
故答案为:2LiFePO4+H2O2+2H+=2Fe3++2Li++2PO43-+2H2O;
(3)锂电池充电时的正极即为阳极,发生氧化反应,反应式为FePO4+Li++e-=LiFePO4,
故答案为:FePO4+Li++e-=LiFePO4;
(4)操作4中是调节PH值,使得铁离子沉淀完全,应选择试剂为NaOH,由于Ksp[Fe(OH)3]=4×10-38
,要使铁离子沉淀完全,即c(Fe 3+ )<10-5mol/L,所以此时c(OH- )>
=
×10-11mol/L,即pH=3.2,所以要将溶液调节pH值至PH>3.2,
故答案为:NaOH;大于3.2;
(5)根据上面的分析可知,沉淀C的成分为Li2CO3,
故答案为:Li2CO3;
(6)磷酸铁也可以通过电解法制备,如右图2,铁作阳极生成亚铁离子,亚铁离子被双氧水氧化成铁离子,再结合磷酸根离子生成磷酸铁,所以制备过程的总反应离子方程式为:Fe2++H2O2+2PO43-=2FePO4+H2O,
故答案为:Fe2++H2O2+2PO43-=2FePO4+H2O.
(1)根据影响反应速率的因素可知,提高操作1浸出率的方法有升温,搅拌,增大浓度,增加时间等,
故答案为:升温,搅拌,增大浓度,增加时间等;
(2)操作3中加入双氧水,将亚铁离子氧化成铁离子,反应的离子方程式为:2LiFePO4+H2O2+2H+=2Fe3++2Li++2PO43-+2H2O,
故答案为:2LiFePO4+H2O2+2H+=2Fe3++2Li++2PO43-+2H2O;
(3)锂电池充电时的正极即为阳极,发生氧化反应,反应式为FePO4+Li++e-=LiFePO4,
故答案为:FePO4+Li++e-=LiFePO4;
(4)操作4中是调节PH值,使得铁离子沉淀完全,应选择试剂为NaOH,由于Ksp[Fe(OH)3]=4×10-38
,要使铁离子沉淀完全,即c(Fe 3+ )<10-5mol/L,所以此时c(OH- )>
| 3 |
| ||
| 3 | 4 |
故答案为:NaOH;大于3.2;
(5)根据上面的分析可知,沉淀C的成分为Li2CO3,
故答案为:Li2CO3;
(6)磷酸铁也可以通过电解法制备,如右图2,铁作阳极生成亚铁离子,亚铁离子被双氧水氧化成铁离子,再结合磷酸根离子生成磷酸铁,所以制备过程的总反应离子方程式为:Fe2++H2O2+2PO43-=2FePO4+H2O,
故答案为:Fe2++H2O2+2PO43-=2FePO4+H2O.
看了 锂离子电池的广泛应用使得锂电...的网友还看了以下:
英语翻译中小学现代教学媒体的应用研究摘要:如今,现代教学媒体在中小学教学中的应用越来越广泛.本文主 2020-06-04 …
我要三好生演讲稿,别写得过什么什么奖,学习也别写得太好,体育也别写得太好,要写兴趣广泛之类的今天就 2020-06-10 …
阅读下面的这首诗,回答问题。晓至湖上(清)厉鹗出郭晓色微,临水人意静。水上寒雾生,弥漫与天永。折① 2020-06-21 …
某同学用量筒测量小石块的体积,图中测得水的体积为,水和小石块的体积为,则小石块体积为;若在图中第一 2020-07-16 …
能具体解释如何用压缩映射定理吗(泛函分析)证明:存在闭区间[0,1]上的连续函数x(t),使得能具 2020-07-29 …
某校为了增强学生体质,推动“阳光体育”运动的广泛开展,学校准备购买一批运动鞋供学生借用,学校体育部 2020-08-02 …
被誉为中国“新四大发明”之一的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得 2020-11-03 …
一个狼和鹿的故事反映什么哲学大体是这样的,狼吃鹿,人们为了保护鹿而大肆的杀狼,导致鹿的数量泛滥,草场 2020-11-20 …
沙市区在中小学中广泛开展的“跑操”活动,不仅可以增强学生体质,还能提高免疫力,预防传染病.从预防传染 2020-12-29 …
读下面这首诗歌,回答读下面这首诗歌,晓至湖①上[清]厉鹗出郭晓色微,临水人意静.水上寒雾生,弥漫与天 2021-01-12 …