早教吧作业答案频道 -->化学-->
氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用.(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大
题目详情
氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用.
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H1
②4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H2
则反应 4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H=___.(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3L的恒容密闭容器中,投入4mol N2和9mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
已知:破坏1mol N2(g)和3mol H2(g)中的化学键吸收的总能量小于形成2mol NH3(g)中的化学键放出的总能量.①则T1___T2(填“>”、“<”或“=”)
②在T2时,经过10min达到化学平衡状态,则0至10min内H2的平均反应速率v(H2)=___,平衡时N2的转化率α(N2)=___.
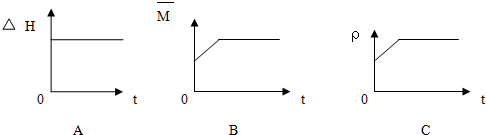
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量(
)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是___.
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H1
②4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H2
则反应 4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H=___.(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3L的恒容密闭容器中,投入4mol N2和9mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
②在T2时,经过10min达到化学平衡状态,则0至10min内H2的平均反应速率v(H2)=___,平衡时N2的转化率α(N2)=___.
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量(
| . |
| M |

▼优质解答
答案和解析
(1)由①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H2
结合盖斯定律可知,(①×3+②×2)×
得到4NH3(g)+3O2(g)=2N2(g)+6H2O(l),则△H=
,
故答案为:
;
(2)破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量,则合成氨的反应为放热反应,
①由表格数据可知,T1对应的氨气平衡时物质的量大,则T1的温度低,则T1<T2,
故答案为:<;
②T2K下,经过10min达到化学平衡状态,则
N2+3 H2⇌2NH3,
开始 4 9 0
转化 1 3 2
平衡 3 6 2
v(H2)=
=
=0.1mol•L-1•min-1,
平衡时N2的转化率α(N2)=
×100%=25%,
故答案为:0.1mol•L-1•min-1;25%;
③焓变(△H)始终不变,混合气体平均相对分子质量(
)为变量、N2体积分数φ(N2)为变量,气体密度(ρ)始终不变,随反应进行,气体的物质的量减小,则
随时间增大而增大,直到达到平衡状态不变;N2体积分数逐渐减小,到达到平衡状态不变,由图可知,正确且能表明该可逆反应达到平衡状态的为BC,
故答案为:BC.
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H2
结合盖斯定律可知,(①×3+②×2)×
| 1 |
| 5 |
| 3△H 1+2△H 2 |
| 5 |
故答案为:
| 3△H 1+2△H 2 |
| 5 |
(2)破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量,则合成氨的反应为放热反应,
①由表格数据可知,T1对应的氨气平衡时物质的量大,则T1的温度低,则T1<T2,
故答案为:<;
②T2K下,经过10min达到化学平衡状态,则
N2+3 H2⇌2NH3,
开始 4 9 0
转化 1 3 2
平衡 3 6 2
v(H2)=
| △c |
| △t |
| ||
| 10min |
平衡时N2的转化率α(N2)=
| 1 |
| 4 |
故答案为:0.1mol•L-1•min-1;25%;
③焓变(△H)始终不变,混合气体平均相对分子质量(
. |
| M |
. |
| M |
故答案为:BC.
看了 氮的氢化物NH3、N2H4等...的网友还看了以下:
1.学校的厕所一段时间就要用洁厕剂彻底清洗一次.如果洁厕剂用完了,浓度较高的硫酸也可以替代洁厕剂. 2020-04-06 …
老张的儿子今年读初二,由于老张的工作较忙,平时很少有时问管儿子,近期发现儿子课余时间总是喜欢 2020-06-04 …
清凉电扇分厂6月份生产订单较多,职工全月不放假,而且从第一天起,每天都从总厂陆续派相同人数的工人到 2020-06-05 …
请问做菌落总数的实验时,菌落是怎么看的?怎么培养皿中的点有些比较大,比较清晰,有些很小,数不太清, 2020-06-21 …
有2卷合金丝,其中一卷丝上的标签显示:直径0.3mm,另一卷丝的直径较细,不知直径的值,下面是问题 2020-06-30 …
形容醉酒的词语现在我的工作每天都比较繁忙,有时还会忙到很晚,那时候就会陪着工人在外面一起吃饭喝酒, 2020-07-24 …
乾隆时期,苏州地区“佣工之人,计日受值,各有常主。其无常主者,黎明立桥头以待唤”。这种情况说明了A 2020-07-26 …
电影《十二生肖》中的兽首铜像是在乾隆帝时期由宫廷工匠们精心制作的,铸工精整,清晰逼真,展现出极高的 2020-07-28 …
据统计,道光以前佛山共有商业会馆25所,手工业会馆26所。全镇的工商店号在3000家以上,铺户贸易和 2020-11-10 …
电影《十二生肖》中的兽首铜像是在乾隆帝时由宫廷工匠们精心制作的,铸工精整,清晰逼真,展现出极高的工艺 2020-12-26 …