早教吧作业答案频道 -->化学-->
氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用.(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方较化石燃料和氢燃料有着较大的
题目详情
氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用.
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2 (g)=4NO (g)+6H2O (L)△H1
②4NH3(g)+6NO(g)=5N2 (g)+6H2O (L)△H2
则反应 4NH3(g)+3O2(g)=2N2 (g)+6H2O (L)△H=___(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3L的恒容密闭容器中,投入4mol N2和9mol N2 在一定条件下合成氮,平衡时仅改变温度测得的数据如下表所示:
已知:破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量.
①则 T1、___T2(填“>”、“<”或“=”)
②T2K下,经过10min达到化学平衡状态,则o~10min内H2的平均速率v(H2)=___.
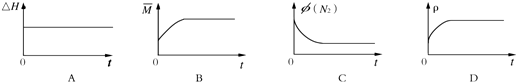
③下列图象分别代表焓变(△H),混合气体平均相对分子质量(
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态是___.
(3)电化学降解治理水中硝酸盐污染,在酸性条件下,电化学降解NO3-的原理如图1,阴极反应式为___.
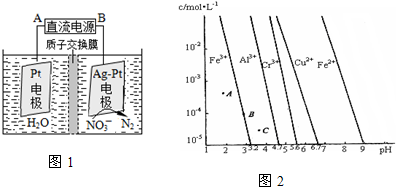
(4)通过控制溶液的pH对工业废水中的金属离子进行分离.图2是某些金属氢氧化物在不同浓度和pH的沉淀--溶解图象,图中直线上的点表示平衡状态.当溶液中的离子浓度小于1×10-5mol•L-1时,认为该离子沉淀完全.
由图可知Cu(OH)2的浓度积的值为___.
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2 (g)=4NO (g)+6H2O (L)△H1
②4NH3(g)+6NO(g)=5N2 (g)+6H2O (L)△H2
则反应 4NH3(g)+3O2(g)=2N2 (g)+6H2O (L)△H=___(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3L的恒容密闭容器中,投入4mol N2和9mol N2 在一定条件下合成氮,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则 T1、___T2(填“>”、“<”或“=”)
②T2K下,经过10min达到化学平衡状态,则o~10min内H2的平均速率v(H2)=___.
③下列图象分别代表焓变(△H),混合气体平均相对分子质量(
| . |
| M |

(3)电化学降解治理水中硝酸盐污染,在酸性条件下,电化学降解NO3-的原理如图1,阴极反应式为___.

(4)通过控制溶液的pH对工业废水中的金属离子进行分离.图2是某些金属氢氧化物在不同浓度和pH的沉淀--溶解图象,图中直线上的点表示平衡状态.当溶液中的离子浓度小于1×10-5mol•L-1时,认为该离子沉淀完全.
由图可知Cu(OH)2的浓度积的值为___.
▼优质解答
答案和解析
(1)由①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H2
结合盖斯定律可知,(①×3+②×2)×
得到4NH3(g)+3O2(g)=2N2(g)+6H2O(l),则△H=
,
故答案为:
;
(2)破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量,则合成氨的反应为放热反应,
①由表格数据可知,T1对应的氨气平衡时物质的量大,则T1的温度低,则T1<T2,故答案为:<;
②T2K下,经过10min达到化学平衡状态,则
N2+3 H2⇌2NH3,
开始 4 9 0
转化 1 3 2
平衡 3 6 2
v(H2)=
=
=0.1mol•L-1•min-1,
故答案为:0.1mol•L-1•min-1;
③焓变(△H)始终不变,混合气体平均相对分子质量(
)为变量、N2体积分数φ(N2)为变量,气体密度(ρ)始终不变,随反应进行,气体的物质的量减小,则
随时间增大而增大,直到达到平衡状态不变;N2体积分数逐渐减小,到达到平衡状态不变,由图可知,正确且能表明该可逆反应达到平衡状态的为BC,
故答案为:BC;
(3)由图可知,硝酸根离子发生还有反应生成氮气,则Ag-Pt电极为阴极,Pt电极为阳极,则A为电池的正极,阴极上硝酸根获得电子,与通过质子交换膜的氢离子作用生成氮气与水,阴极电极反应式为:2NO3-+12H++10e-=N2↑+6H2O,
故答案为:2NO3-+12H++10e-=N2↑+6H2O;
(4)由图象可知,当PH=5.6时,c(Cu2+)=1×10-5mol•L-1,Ksp=c(Cu2+)•c2(OH-)=1×10-5×(1×10-8.4)2 =1×10-21.8,故答案为:1×10-21.8.
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H2
结合盖斯定律可知,(①×3+②×2)×
| 1 |
| 5 |
| 3△H1+2△H2 |
| 5 |
故答案为:
| 3△H1+2△H2 |
| 5 |
(2)破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量,则合成氨的反应为放热反应,
①由表格数据可知,T1对应的氨气平衡时物质的量大,则T1的温度低,则T1<T2,故答案为:<;
②T2K下,经过10min达到化学平衡状态,则
N2+3 H2⇌2NH3,
开始 4 9 0
转化 1 3 2
平衡 3 6 2
v(H2)=
| △c |
| △t |
| ||
| 10min |
故答案为:0.1mol•L-1•min-1;
③焓变(△H)始终不变,混合气体平均相对分子质量(
. |
| M |
. |
| M |
故答案为:BC;
(3)由图可知,硝酸根离子发生还有反应生成氮气,则Ag-Pt电极为阴极,Pt电极为阳极,则A为电池的正极,阴极上硝酸根获得电子,与通过质子交换膜的氢离子作用生成氮气与水,阴极电极反应式为:2NO3-+12H++10e-=N2↑+6H2O,
故答案为:2NO3-+12H++10e-=N2↑+6H2O;
(4)由图象可知,当PH=5.6时,c(Cu2+)=1×10-5mol•L-1,Ksp=c(Cu2+)•c2(OH-)=1×10-5×(1×10-8.4)2 =1×10-21.8,故答案为:1×10-21.8.
看了 氮的氢化物NH3、N2H4等...的网友还看了以下:
你能比较两个数20042003和20032004的大小吗?为了解决这个问题,我们首先把它抽象成一般 2020-05-13 …
塑料再生料广泛用于哪?塑料再生料用于什么产品,主要市场在哪?哪种塑料用于比较广泛和普遍塑料再生料市 2020-05-16 …
高粱是被誉为“铁杆庄稼”的高产作物。茎秆很高性喜温暖抗旱、耐涝。因此在世界分布较广自赤道至高纬度均 2020-06-20 …
“某海域海陆轮廓图”,回答31-32题图中N地以东海域有较丰富的渔业资源,对其原因的描述最不可能的 2020-07-05 …
碳酸钙是生活中用途较广泛的物质,但它对人类也有利有弊,如含有碳酸钙的大理石是常用的建筑材料,而含有 2020-07-06 …
材料一平原地球的聚落多成团状,且规模较大;而山谷地区的聚落多呈条带状,且规模较小.材料二沙漠地区的聚 2020-11-12 …
根据昆明和贵阳的气候资料,回答下列问题。材料一:气温年较差、日较差比较表材料二:降水量、降水日数及相 2020-11-13 …
图中N地以东海域有较丰富的渔业资源,对其原因的描述最不可能的是()①有较广阔的浅海大陆架②有寒.暖流 2020-12-16 …
新型无机非金属材料的特性有、、、,目前较广使用的高温结构陶瓷有、、等,广泛应用于光缆通讯的是. 2020-12-21 …
你能比较2007的2008次方和2008的2007次方为了解决这个问题,我们首先把它抽象成一般形式, 2021-01-14 …