早教吧作业答案频道 -->化学-->
研究表明,生活污水中氮的存在形式主要以有机氮和氨氮为主.作为污水中无机氮的主要组成,氨氮在充当无机营养物的同时也是造成水体富营养化的主要原因.(1)现采样获得某城市污水
题目详情
研究表明,生活污水中氮的存在形式主要以有机氮和氨氮为主.作为污水中无机氮的主要组成,氨氮在充当无机营养物的同时也是造成水体富营养化的主要原因.
(1)现采样获得某城市污水中NH4Cl含量为180mg/L.
①NH4Cl含有的化学键类型有___.写出NH4Cl的电子式:___.
②NH4Cl溶液显酸性,用离子方程式表示其原因___.其溶液中离子浓度大小的顺序为:___.
③为除去氨氮废水中的NH4+,向103 L该污水中加入0.1mol/L NaOH溶液,理论上需要NaOH溶液的体积为___L(计算结果保留两位小数).加入NaOH溶液后还需不断的通入空气,用化学平衡原理解释通空气的目的:___.
(2)当污水中同时存在NH4+和NO时.可将NH4+最终转化为N2.也可将NO3-转化为NH4+,然后再除去.
①在微生物作用的条件下,可先利用O2将NH4+氧化成NO3-,再加入CH3OH,将NO3-还原成N2.写出NH4+与O2反应生成NO3-的离子方程式___.
②酸性条件下,可在污水中加入铁屑将NO3-转化为NH4+.研究表明溶液pH会影响铁屑脱氮的效果,反应体系的pH分别控制在4 和8.5 时,NO3-的去除率分别为90% 和15%.正常地下水中含有CO32-,会影响铁屑脱氮的效果,用化学用语和文字简述其原因___.
(1)现采样获得某城市污水中NH4Cl含量为180mg/L.
①NH4Cl含有的化学键类型有___.写出NH4Cl的电子式:___.
②NH4Cl溶液显酸性,用离子方程式表示其原因___.其溶液中离子浓度大小的顺序为:___.
③为除去氨氮废水中的NH4+,向103 L该污水中加入0.1mol/L NaOH溶液,理论上需要NaOH溶液的体积为___L(计算结果保留两位小数).加入NaOH溶液后还需不断的通入空气,用化学平衡原理解释通空气的目的:___.
(2)当污水中同时存在NH4+和NO时.可将NH4+最终转化为N2.也可将NO3-转化为NH4+,然后再除去.
①在微生物作用的条件下,可先利用O2将NH4+氧化成NO3-,再加入CH3OH,将NO3-还原成N2.写出NH4+与O2反应生成NO3-的离子方程式___.
②酸性条件下,可在污水中加入铁屑将NO3-转化为NH4+.研究表明溶液pH会影响铁屑脱氮的效果,反应体系的pH分别控制在4 和8.5 时,NO3-的去除率分别为90% 和15%.正常地下水中含有CO32-,会影响铁屑脱氮的效果,用化学用语和文字简述其原因___.
▼优质解答
答案和解析
(1)①NH4Cl含有离子键和共价键,其电子式为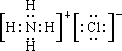 ,故答案为:离子键和共价键;
,故答案为:离子键和共价键;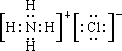 ;
;
②氯化铵为强酸弱碱盐,水解呈酸性,铵根离子水解的离子方程式为NH4++H2O⇌H++NH3•H2O,铵根离子水解,则(Cl-)>c(NH4+),所以溶液中离子浓度关系为:(Cl-)>c(NH4+)>c(H+)>c(OH-);
故答案为:NH4++H2O⇌H++NH3•H2O;(Cl-)>c(NH4+)>c(H+)>c(OH-);
③由 NH4Cl~~~~~NaOH,
53.5g 1mol
180mg/L×103 L×103 g/mg 0.1mol/L×V,
=
,解之得:V=33.64L,污水中的氨气被空气带走,有利于NH3•H2O⇌NH3+H2O的平衡正向移动,利于除去氮,故答案为:33.64L;污水中的氨气被空气带走,有利于NH3•H2O⇌NH3+H2O的平衡正向移动,利于除去氮;
(2)①1mol铵根离子反应生成亚硝酸根时转移6mol电子,1mol氧气反应转移4mol电子,据最小公倍法可知,铵根离子化学计量数为2,氧气化学计量数为3,所以反应的离子方程式为:2NH4++3O2═2NO2-+4H++H2O,故答案为:2NH4++3O2═2NO2-+4H++H2O;
②CO32-水解呈碱性,CO32-+H2O⇌HCO3-+OH-,pH增大,且发生Fe2++CO32-=FeCO3↓,可生成FeCO3沉淀而阻止反应进行,
故答案为:CO32-+H2O⇌HCO3-+OH-增大了溶液的pH会降低脱氮效果,且Fe2++CO32-=FeCO3↓覆盖在反应物的表面阻止反应进行.
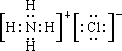 ,故答案为:离子键和共价键;
,故答案为:离子键和共价键;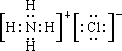 ;
;②氯化铵为强酸弱碱盐,水解呈酸性,铵根离子水解的离子方程式为NH4++H2O⇌H++NH3•H2O,铵根离子水解,则(Cl-)>c(NH4+),所以溶液中离子浓度关系为:(Cl-)>c(NH4+)>c(H+)>c(OH-);
故答案为:NH4++H2O⇌H++NH3•H2O;(Cl-)>c(NH4+)>c(H+)>c(OH-);
③由 NH4Cl~~~~~NaOH,
53.5g 1mol
180mg/L×103 L×103 g/mg 0.1mol/L×V,
| 53.5 |
| 180 |
| 1 |
| 0.1V |
(2)①1mol铵根离子反应生成亚硝酸根时转移6mol电子,1mol氧气反应转移4mol电子,据最小公倍法可知,铵根离子化学计量数为2,氧气化学计量数为3,所以反应的离子方程式为:2NH4++3O2═2NO2-+4H++H2O,故答案为:2NH4++3O2═2NO2-+4H++H2O;
②CO32-水解呈碱性,CO32-+H2O⇌HCO3-+OH-,pH增大,且发生Fe2++CO32-=FeCO3↓,可生成FeCO3沉淀而阻止反应进行,
故答案为:CO32-+H2O⇌HCO3-+OH-增大了溶液的pH会降低脱氮效果,且Fe2++CO32-=FeCO3↓覆盖在反应物的表面阻止反应进行.
看了 研究表明,生活污水中氮的存在...的网友还看了以下:
探究如何从土壤中分离探究如何从土壤中分离自生固氮菌与计数.实验原理:农田的表层土壤中,自生固氮菌的 2020-05-17 …
下面是最早发现青霉素时,弗莱明所进行的观察和研究过程在培养细菌的培养基上偶然见到青霉菌,在其周围无 2020-05-21 …
在探究“检测不同环境中的细菌和真菌”的实验中,培养用的培养皿和培养基,在接种前必须高温处理,其目的 2020-06-18 …
七年级科学实验探究:取3个装牛肉汁的培养皿,第一个培养皿涂沫擦取手心的无菌棉花签;打开第二个培养皿 2020-06-30 …
(10分)(能力拔高题)探究镍是植物生活所必需的无机盐。材料用具:完全营养液甲、缺镍的营养液乙、适 2020-06-30 …
某学习小组想探究消毒剂对细菌生长控制的能力究竟如何,他们进行了如下的实验:①用手指分别在3个封闭的 2020-07-02 …
种子含有丰富的营养,那么到底含有哪些营养物质呢?有同学提出了这样的问题,请你进行探究.同学们提出了 2020-07-28 …
研究表明,生活污水中氮的存在形式主要以有机氮和氨氮为主.作为污水中无机氮的主要组成,氨氮在充当无机 2020-07-28 …
下列对植物组织培养和动物细胞培养的叙述正确的是()A.前者需用固体培养基,其大多是由无机营养成分、有 2020-11-21 …
为了研究病毒,需将其大量培养,你认为下列何种培养方式最适宜?A无菌的牛肉汤B含有多种无机盐的培养液C 2020-12-04 …