早教吧作业答案频道 -->化学-->
实验室以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)为原料制取CaCl2•2H2O和CaO2的主要流程如图1:(1)加入试剂X,调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,滤渣的主要成分是.试剂
题目详情
实验室以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)为原料制取CaCl2•2H2O和CaO2的主要流程如图1:
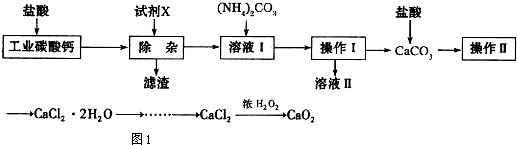
(1)加入试剂X,调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,滤渣的主要成分是___.试剂X可以选择下列的___(填编号).
A.CaO B.CaCO3 C.NH3•H2O D.Ba(OH)2
(2)操作II中进行蒸发浓缩时,除三角架、酒精灯外,还需要的仪器有___.
(3)由CaCl2制取CaO2的反应中,温度不宜太高的原因是___.
(4)用图2装置测定工业碳酸钙的质量分数
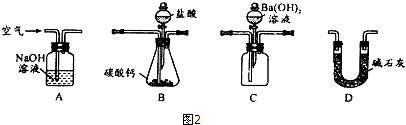
①检验装置B气密性良好的实验过程是___.
②按A-B-C-D顺序连接,然后从A装置通入空气,目的是___;
③装置D的作用为___.
④实验时,准确称取10.00g工业碳酸钙3份,进行3次测定,测得BaCO3沉淀的平均质量为17.73g,则样品中CaCO3的质量分数为___.

(1)加入试剂X,调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,滤渣的主要成分是___.试剂X可以选择下列的___(填编号).
A.CaO B.CaCO3 C.NH3•H2O D.Ba(OH)2
(2)操作II中进行蒸发浓缩时,除三角架、酒精灯外,还需要的仪器有___.
(3)由CaCl2制取CaO2的反应中,温度不宜太高的原因是___.
(4)用图2装置测定工业碳酸钙的质量分数

①检验装置B气密性良好的实验过程是___.
②按A-B-C-D顺序连接,然后从A装置通入空气,目的是___;
③装置D的作用为___.
④实验时,准确称取10.00g工业碳酸钙3份,进行3次测定,测得BaCO3沉淀的平均质量为17.73g,则样品中CaCO3的质量分数为___.
▼优质解答
答案和解析
(1)调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,可以使之转化为氢氧化物沉淀而除去滤渣的主要成分是氢氧化铝和氢氧化铁,为了保证不引入杂质离子,所以中和盐酸的酸性调节pH值可以用氧化钙或是碳酸钙,故答案为:Fe(OH)3、Al(OH)3;AB;
(2)根据蒸发操作所需仪器有玻璃棒、蒸发皿、酒精灯、三脚架,故答案为:玻璃棒和蒸发皿;
(3)根据温度过高会导致双氧水分解,引起实验误差,故答案为:温度过高会导致双氧水分解;
(4)①根据气压原理来判断装置的气密性,方法是关闭导管出口以及分液漏斗的瓶塞,打开分液漏斗的旋塞,液体不往下滴,证明气密性良好,故答案为:关闭导管出口以及分液漏斗的瓶塞,打开分液漏斗的旋塞,液体不往下滴,证明气密性良好;
②根据实验原理,保证碳酸钙和盐酸反应产生的二氧化碳的放出是关键,所以从A装置通入空气,目的是保证碳酸钙和盐酸反应产生的二氧化碳全部进入下一个装置,故答案为:让生成的二氧化碳全部放出,进入C装置,确保实验结果的准确性;
③碳酸钙和盐酸反应产生的二氧化碳的量不能受外界空气中二氧化碳和水的干扰,装置D的作用为防止空气中的二氧化碳进入装置C中,引起实验误差,故答案为:防止空气中的二氧化碳进入装置C中,引起实验误差;
④根据碳酸钙中碳元素守恒,碳酸钙中的碳元素先成为二氧化碳,然后是二氧化碳在和氢氧化钡反应得到碳酸钡沉淀,碳酸钡中的碳元素全部来自碳酸钙中,所以17.73gBaCO3沉淀的物质的量为17.73g÷197g•mol-1=0.09mol,所以碳酸钙的物质的量是0.09mol,质量是9g,百分含量是9g÷10.00g×100%=90.00%,故答案为:90.00%.
(2)根据蒸发操作所需仪器有玻璃棒、蒸发皿、酒精灯、三脚架,故答案为:玻璃棒和蒸发皿;
(3)根据温度过高会导致双氧水分解,引起实验误差,故答案为:温度过高会导致双氧水分解;
(4)①根据气压原理来判断装置的气密性,方法是关闭导管出口以及分液漏斗的瓶塞,打开分液漏斗的旋塞,液体不往下滴,证明气密性良好,故答案为:关闭导管出口以及分液漏斗的瓶塞,打开分液漏斗的旋塞,液体不往下滴,证明气密性良好;
②根据实验原理,保证碳酸钙和盐酸反应产生的二氧化碳的放出是关键,所以从A装置通入空气,目的是保证碳酸钙和盐酸反应产生的二氧化碳全部进入下一个装置,故答案为:让生成的二氧化碳全部放出,进入C装置,确保实验结果的准确性;
③碳酸钙和盐酸反应产生的二氧化碳的量不能受外界空气中二氧化碳和水的干扰,装置D的作用为防止空气中的二氧化碳进入装置C中,引起实验误差,故答案为:防止空气中的二氧化碳进入装置C中,引起实验误差;
④根据碳酸钙中碳元素守恒,碳酸钙中的碳元素先成为二氧化碳,然后是二氧化碳在和氢氧化钡反应得到碳酸钡沉淀,碳酸钡中的碳元素全部来自碳酸钙中,所以17.73gBaCO3沉淀的物质的量为17.73g÷197g•mol-1=0.09mol,所以碳酸钙的物质的量是0.09mol,质量是9g,百分含量是9g÷10.00g×100%=90.00%,故答案为:90.00%.
看了 实验室以工业碳酸钙(含少量N...的网友还看了以下:
写出下列反应的化学方程式①实验室制乙炔:②工业以乙炔为主要原料制聚氯乙烯:,nH2C=CHCl催化 2020-04-08 …
以下属于药剂学的分支学科的是()A.工业药剂学B.物理药剂学C.药用高分子材料学D.生物化学E.药物 2020-06-07 …
有5辆汽车要派到8个地点运送货物,下图中O内的数字表示8个地点完成任务需要的装卸工人数.如果装卸工 2020-06-20 …
PCB板加工中以下缩写是什么工艺?2PP+2SP+2LP+STH+Carbonkey+Punche 2020-06-23 …
液氮降雨剂是一种新型人工降雨剂,下列关于液氮降雨剂的做法正确的是()A.使用该降雨剂会污染空气B. 2020-06-30 …
氯化钙可常用作干燥剂、融雪剂等.某工厂以石灰石粉末为原料(其中杂质主要有MgCO3和Al2O3等物质 2020-11-03 …
2006年5月15日,国家食品药品监督管理局通报查处了齐齐哈尔第二制药有限公司使用工业溶剂二甘醇(H 2020-12-17 …
造高级生活用纸生产工艺,以及生产过程中如何使用造纸分散剂,以及造纸废水的泥水分离如何使用絮凝剂?絮凝 2020-12-25 …
2006年5月15日,国家食品药品监督管理局通报查处了齐齐哈尔第二制药有限公司使用工业溶剂二甘醇(H 2021-01-01 …
(6分)氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。某工厂以石灰石为原料生产二水 2021-01-17 …