早教吧作业答案频道 -->化学-->
某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件.供选试剂:30%H2O2溶液、0.1mol/LH2SO4溶液、MnO2固体、KMnO4固体(1)小组同学设计甲、乙、丙三组实验,记录如表
题目详情
某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件.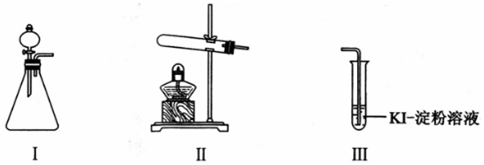
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如表:
(2)丙实验中O2与KI溶液反应的离子方程式是___.
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___.为进一步探究该条件对反应速率的影响,可采取的实验措施是___.
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝.学生将I中产生的气体直接通入下列___溶液(填序号),证明了白雾中含有H2O2.
A.酸性 KMnO4 B.FeCl2 C.Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH.该小组同学取20mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)___造成的,请设计实验证明他们的猜想是否正确___.

供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如表:
| 操作 | 现象 | |
| 甲 | 向I的锥形瓶中加入 ___,.向I的 ___中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
| 丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___.为进一步探究该条件对反应速率的影响,可采取的实验措施是___.
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝.学生将I中产生的气体直接通入下列___溶液(填序号),证明了白雾中含有H2O2.
A.酸性 KMnO4 B.FeCl2 C.Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH.该小组同学取20mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)___造成的,请设计实验证明他们的猜想是否正确___.
▼优质解答
答案和解析
(1)甲实验:根据装置Ⅰ不需要加热制取氧气可知利用的是双氧水的分解,过氧化氢在二氧化锰催化作用下分解生成氧气,向I的锥形瓶中加入MnO2固体,向I的分液漏斗中加入30% H2O2溶液,连接I、Ⅲ,打开活塞,I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝说明生成碘单质,
故答案为:MnO2固体;分液漏斗;
(2)碘离子具有还原性,在酸性条件下能够被氧化氧化成碘单质,据此写出反应的离子方程式为:O2+4I-+4H+=2I2+2H2O,
故答案为:O2+4I-+4H+=2I2+2H2O;
(3)向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯,Ⅲ中有气泡冒出,溶液不变蓝,向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯,Ⅲ中有气泡冒出,溶液变蓝对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是:酸性环境;为进一步探究该条件对反应速率的影响,可采取的实验措施是:使用不同浓度的稀硫酸作对比实验,
故答案为:酸性环境;使用不同浓度的稀硫酸作对比实验;
(4)A.KMnO4,高锰酸钾溶液能够将双氧水氧化,导致高锰酸钾溶液褪色,而氧气不与高锰酸钾溶液反应,如果高锰酸钾溶液褪色可证明混合气体中含有双氧水,故A正确;
B.FeCl2,氧气和高锰酸钾溶液都能够氧化亚铁离子,无法证明混合气体中含有双氧水,故B错误;
C.Na2S,高锰酸钾和氧气都能够氧化硫化钠,无法用硫化钠检验混合气体中是否含有双氧水,故C错误;
D.品红遇到过氧化氢会被氧化红色褪去,证明混合气体中含有双氧水,故D正确;
故答案为:AD;
(5)KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH.该小组同学取20mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应的离子方程式为:3I2+6OH-=5I-+IO3-+3H2O,设计实验证明他们的猜想是否正确升温方案为:在上述未变蓝的溶液中滴入0.1mol/LH2SO4溶液观察现象,若溶液变蓝则猜想正确,否则错误,
故答案为:3I2+6OH-=5I-+IO3-+3H2O;在上述未变蓝的溶液中滴入0.1mol/LH2SO4溶液观察现象,若溶液变蓝则猜想正确,否则错误.
故答案为:MnO2固体;分液漏斗;
(2)碘离子具有还原性,在酸性条件下能够被氧化氧化成碘单质,据此写出反应的离子方程式为:O2+4I-+4H+=2I2+2H2O,
故答案为:O2+4I-+4H+=2I2+2H2O;
(3)向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯,Ⅲ中有气泡冒出,溶液不变蓝,向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯,Ⅲ中有气泡冒出,溶液变蓝对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是:酸性环境;为进一步探究该条件对反应速率的影响,可采取的实验措施是:使用不同浓度的稀硫酸作对比实验,
故答案为:酸性环境;使用不同浓度的稀硫酸作对比实验;
(4)A.KMnO4,高锰酸钾溶液能够将双氧水氧化,导致高锰酸钾溶液褪色,而氧气不与高锰酸钾溶液反应,如果高锰酸钾溶液褪色可证明混合气体中含有双氧水,故A正确;
B.FeCl2,氧气和高锰酸钾溶液都能够氧化亚铁离子,无法证明混合气体中含有双氧水,故B错误;
C.Na2S,高锰酸钾和氧气都能够氧化硫化钠,无法用硫化钠检验混合气体中是否含有双氧水,故C错误;
D.品红遇到过氧化氢会被氧化红色褪去,证明混合气体中含有双氧水,故D正确;
故答案为:AD;
(5)KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH.该小组同学取20mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应的离子方程式为:3I2+6OH-=5I-+IO3-+3H2O,设计实验证明他们的猜想是否正确升温方案为:在上述未变蓝的溶液中滴入0.1mol/LH2SO4溶液观察现象,若溶液变蓝则猜想正确,否则错误,
故答案为:3I2+6OH-=5I-+IO3-+3H2O;在上述未变蓝的溶液中滴入0.1mol/LH2SO4溶液观察现象,若溶液变蓝则猜想正确,否则错误.
看了 某化学小组同学用下列装置和试...的网友还看了以下:
(七他上七•宝鸡三模)(上)已知:4(5)+O七(g)=4O七(g)△H=-393.5kJ/右ol 2020-04-07 …
二氧化碳是一种温室气体.某化学兴趣小组利用如图所示装置制取二氧化碳并对二氧化碳的性质进行验证,回答 2020-04-11 …
回答第2小题中的A就好常温常压下1体积水约溶解1体积二氧化碳气体,氢氧化钠溶液与二氧化碳反应时没有 2020-04-26 …
关于化合价的问题,O的化合价为-2,是不是也就是说在O在反应中要得到两个负电荷?和O反应的那种物质 2020-05-20 …
x芳用如下图装置进行“人体呼出的气体o的四氧化碳是否比吸入的空气o的四氧化碳含量多”的探究实验.实 2020-06-12 …
关于位移和路程,下列理解正确的是()A.位移是描述物体位置变化的物理量B.路程是精确描述物体位置变化 2020-11-11 …
下列关于速度的说法中,正确的是()A.速度是描述物体位置变化的物理量B.速度是描述物体位置变化大小的 2020-12-09 …
化学实验有助于理解化学知识,形成化学观念,提升科学素.用如图所示装置进行实验(夹持装置已省略).请完 2020-12-19 …
氮氧化物(NOx)等气体破坏人类生存的环境.(1)汽车尾气净化装置里装有Pd等过渡元素的催化剂,气体 2020-12-24 …
下列关于速度的说法中,正确的是()A.速度是描述物体位置变化的物理量B.速度是描述物体位置变化大小的 2021-01-29 …