早教吧作业答案频道 -->化学-->
由水钴矿[主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如下:已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.②流程中部分阳离子以氢
题目详情
由水钴矿[主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如下:
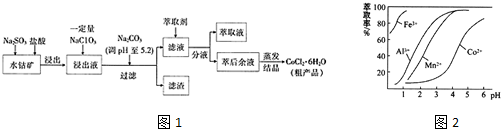
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
③CoCl2•6H2O熔点为86℃,加热至110-120℃时,失去结晶水生成CoCl2.
回答下列问题:
(1)浸出过程中Co2O3发生反应的化学方程式为___
(2)NaClO3在浸出液中发生反应的离子方程式为___
(3)“加Na2CO3调pH至5.2”,过滤所得滤渣的主要成分为___(填化学式).
(4)萃取剂对金属离子的萃取与溶液pH的关系如图2所示,向“滤液”中加入萃取剂的目的是___,其使用的最佳pH范围是___(填选项字母)
A.2.0-2.5 B.3.0-3.5C.4.0-4.5 D.5.0-5.5
(5)制得的CoCl2•6H2O在烘干时需减压烘干的原因是___.为测定粗产品中CoCl2•6H2O含量.称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是(写两条):①___,②___.

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)浸出过程中Co2O3发生反应的化学方程式为___
(2)NaClO3在浸出液中发生反应的离子方程式为___
(3)“加Na2CO3调pH至5.2”,过滤所得滤渣的主要成分为___(填化学式).
(4)萃取剂对金属离子的萃取与溶液pH的关系如图2所示,向“滤液”中加入萃取剂的目的是___,其使用的最佳pH范围是___(填选项字母)
A.2.0-2.5 B.3.0-3.5C.4.0-4.5 D.5.0-5.5
(5)制得的CoCl2•6H2O在烘干时需减压烘干的原因是___.为测定粗产品中CoCl2•6H2O含量.称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是(写两条):①___,②___.
▼优质解答
答案和解析
含钴废料中加入盐酸和亚硫酸钠,Co2O3、Co(OH)3、Fe2O3、Al2O3、MnO和稀盐酸反应生成可溶性的CoCl2、AlCl3、FeCl2、MnCl2、NaCl,然后向溶液中加入氯酸钠,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,然后过滤,向滤液中加入萃取剂,将锰离子萃取,萃取后的溶液中主要含有CoCl2,为得到CoCl2•6H2O晶体,将溶液蒸发浓缩、冷却结晶而得到粗产品,
(1)亚硫酸根离子具有还原性,Co2O3具有氧化性,浸出过程中Co2O3和亚硫酸钠发生氧化还原反应生成硫酸根离子和Co2+,化学方程式为:Co2O3+Na2SO3+4HCl=2CoCl2+Na2SO4+2H2O,
故答案为:Co2O3+Na2SO3+4HCl=2CoCl2+Na2SO4+2H2O;
(2)NaClO3具有氧化性,能氧化亚铁离子生成铁离子,氯酸根离子被还原生成氯离子,离子方程式为ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(3)加Na2CO3调pH至5.2,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
故答案为:Fe(OH)3、Al(OH)3;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知
调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去溶液中的Mn2+;B;
(5)CoCl2•6H2O熔点为86℃,加热至110-120℃时,失去结晶水生成CoCl2,制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解,根据CoCl2•6H2O的组成分析,造成产品中CoCl2•6H2O的质量分数大于100%的原因可能是:1、含有含氯离子的杂质,导致氯离子含量大,2、结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大,
故答案为:降低烘干温度,防止产品分解;粗产品含有可溶性氯化物;晶体失去了部分结晶水.
(1)亚硫酸根离子具有还原性,Co2O3具有氧化性,浸出过程中Co2O3和亚硫酸钠发生氧化还原反应生成硫酸根离子和Co2+,化学方程式为:Co2O3+Na2SO3+4HCl=2CoCl2+Na2SO4+2H2O,
故答案为:Co2O3+Na2SO3+4HCl=2CoCl2+Na2SO4+2H2O;
(2)NaClO3具有氧化性,能氧化亚铁离子生成铁离子,氯酸根离子被还原生成氯离子,离子方程式为ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(3)加Na2CO3调pH至5.2,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
故答案为:Fe(OH)3、Al(OH)3;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知
调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去溶液中的Mn2+;B;
(5)CoCl2•6H2O熔点为86℃,加热至110-120℃时,失去结晶水生成CoCl2,制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解,根据CoCl2•6H2O的组成分析,造成产品中CoCl2•6H2O的质量分数大于100%的原因可能是:1、含有含氯离子的杂质,导致氯离子含量大,2、结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大,
故答案为:降低烘干温度,防止产品分解;粗产品含有可溶性氯化物;晶体失去了部分结晶水.
看了 由水钴矿[主要成分为Co2O...的网友还看了以下:
thanks17.用硫酸铁电化浸出黄铜矿精矿工艺中,精矿在阳极浸出的反应比较复杂,其中有一主要反应 2020-04-26 …
南昌已发现各类矿产28种,矿点、矿化石100处,建筑用砂、砖瓦粘土、饰面石材、石灰石和矿泉水等具有 2020-07-01 …
常见的铁矿有赤铁矿,磁铁矿,菱铁矿,黄铁矿等,用黄铁矿炼铁会产生形成酸雨的有害气体.试说明原因.写 2020-07-06 …
CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还 2020-07-19 …
1893年9月在张之洞的主持下,汉阳铁厂在湖北龟山建成投产.1908年3月26日,汉阳铁厂、大冶铁 2020-07-23 …
(2009•衡阳)湖南有“有色金属之乡”的美称,其中全国著名的有色金属矿有的锑矿和水口山的矿. 2020-11-01 …
下列自然资源,全部属于可再生资源的是()A.石油、森林、煤炭、太阳能B.阳光、土地、水、草原C.铁矿 2020-11-03 …
下列各组选项,均属于可再生资源的是()A.森林、水、天然气、铁矿B.石油、森林、煤炭、太阳能C.阳光 2020-11-03 …
1908年盛宣怀将汉阳铁厂、大冶铁矿、萍乡煤矿合并为汉冶萍煤铁厂矿有限公司,成为亚洲最早最大的钢铁煤 2020-11-13 …
我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土 2020-11-30 …