早教吧作业答案频道 -->化学-->
CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:已知:①浸出液含有阳离子主要有H+、Co2+、Fe2+、M
题目详情
CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
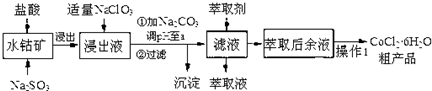
已知:①浸出液含有阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成CoCl2.
(1)写出浸出过程中Co2O3发生反应的离子方程式___.
(2)写出加适量NaClO3发生反应的主要离子方程式___.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀为___.
(4)“操作1”中包含3个基本实验操作,依次是___,___和过滤.
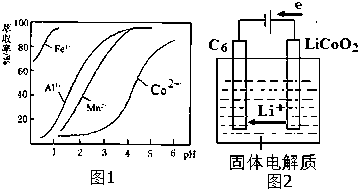
(5)萃取剂对金属离子的萃取率与pH的关系如图1.向“滤液”中加入萃取剂的目的是___;其使用的最佳pH范围是___(填选项序号).
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是___(答一条即可).
(7)已知某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌
入电池负极材料碳-6(C6)中(如图2所示).若该电池的总反应为LiCoO2+C6
CoO2+LiC6,则电池放电时的正极反应式为:___.

已知:①浸出液含有阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式___.
(2)写出加适量NaClO3发生反应的主要离子方程式___.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀为___.
(4)“操作1”中包含3个基本实验操作,依次是___,___和过滤.
(5)萃取剂对金属离子的萃取率与pH的关系如图1.向“滤液”中加入萃取剂的目的是___;其使用的最佳pH范围是___(填选项序号).
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是___(答一条即可).
(7)已知某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌
入电池负极材料碳-6(C6)中(如图2所示).若该电池的总反应为LiCoO2+C6
| 充电 |
| |
| 放电 |

▼优质解答
答案和解析
(1)向水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等],加入盐酸和亚硫酸钠,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,所以Co2O3和亚硫酸钠在酸性条件下发生氧化还原,根据电荷守恒和得失电子守恒,反应的离子方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O,
故答案为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)NaClO3的作用是将Fe2+氧化成Fe3+,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(3)NaClO3的作用是将Fe2+氧化成Fe3+,加Na2CO3调pH至a,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,所以沉淀成分为:Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3、Al(OH)3;
(4)利用从溶液中制取固体的方法制取氯化钴固体,其操作步骤为:蒸发浓缩、冷却结晶和过滤,
故答案为:蒸发(浓缩)、冷却(结晶);
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;
由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去溶液中的Mn2+;B;
(6)根据CoCl2•6H2O的组成分析,造成产品中CoCl2•6H2O的质量分数大于100%的原因可能是:含有杂质,导致氯离子含量大或结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大,
故答案为:粗产品含有可溶性氯化物或晶体失去了部分结晶水;
(7)放电时,该装置为原电池,正极上得电子发生还原反应,电极反应式为CoO2+Li++e-=LiCoO2,
故答案为:CoO2+Li++e-=LiCoO2 .
故答案为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)NaClO3的作用是将Fe2+氧化成Fe3+,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(3)NaClO3的作用是将Fe2+氧化成Fe3+,加Na2CO3调pH至a,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,所以沉淀成分为:Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3、Al(OH)3;
(4)利用从溶液中制取固体的方法制取氯化钴固体,其操作步骤为:蒸发浓缩、冷却结晶和过滤,
故答案为:蒸发(浓缩)、冷却(结晶);
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;
由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去溶液中的Mn2+;B;
(6)根据CoCl2•6H2O的组成分析,造成产品中CoCl2•6H2O的质量分数大于100%的原因可能是:含有杂质,导致氯离子含量大或结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大,
故答案为:粗产品含有可溶性氯化物或晶体失去了部分结晶水;
(7)放电时,该装置为原电池,正极上得电子发生还原反应,电极反应式为CoO2+Li++e-=LiCoO2,
故答案为:CoO2+Li++e-=LiCoO2 .
看了 CoCl2•6H2O是一种饲...的网友还看了以下:
MATLAB 作图 h=[0:300]; v=2.18025*(h-0.6)*sqrt(h/0.3 2020-05-16 …
需要用一元二次方程来解答,急切需要!东方广场要建造圆形的音乐喷水池,为了使水池形状较为漂亮要求设计 2020-05-16 …
1gH2燃烧生成液态水放出142.9KJ的热量,表示该反应的热化学方程式正确的是()A.2H2(g 2020-07-18 …
用竖式计算,并验算.①6.8÷o.h②4.6÷1.h③h.4÷o.18④h.h8÷8.6⑤h.98 2020-07-29 …
(hl11•惠山区一模)(1)李明家5月1日电能表读数为lll1.hkW•h,6月1日电能表读数如m 2020-11-14 …
杨阳家5月1日电能表读数为1852.7kW•h,6月1日电能表读数如图所示,若按0.5元/kW•h计 2020-11-14 …
已知C、I、J是常见的气体,A、D是常见的固态非金属单质,E为常见金属,B可用于生产光导纤维,G、H 2020-11-22 …
的体积露出水面.则关于甲、乙的密度ρ甲、ρ乙及甲、乙最终浸入液体中的深度h甲、h乙,下列判断正确的是 2020-11-29 …
如表是探究温度对酵母菌种群密度(个/mL)影响的实验结果,下列有关叙述正确的是()时间种群密度温度0 2020-12-04 …
题是这样的:一圆柱形油罐,横放,长10米,底面直径2.6米,现油罐内有高为h的水,0.3《h《1米, 2020-12-05 …