早教吧作业答案频道 -->化学-->
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.Ⅰ.制备Na2S2O3•5H2O反应原理:Na2SO3(aq)+S(s)△.
题目详情
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Ⅰ.制备Na2S2O3•5H2O
反应原理:Na2SO3 (aq)+S(s)
Na2S2O3 (aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80mL蒸馏水. 另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中.
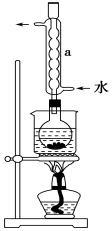
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60分钟.
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤、洗涤、低温干燥,得到产品.
回答问题:
(1)Na2S2O3 中硫元素的化合价为___;Na2S2O3在强酸性溶液中不能稳定存在,其原因为___(用离子方程式表示).
(2)仪器a的名称是___,其作用是___
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是___. 检验其是否存在的方法是___.
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0mol•L-1碘的标准溶液滴定(反应原理为:2S2O32-+I2═S4O62-+2I-).
(4)滴定至终点时,溶液颜色的变化:___.
(5)滴定结束后消耗碘的标准溶液体积为20.00mL.产品的纯度为(用含W的代数式表示)___.
Ⅰ.制备Na2S2O3•5H2O
反应原理:Na2SO3 (aq)+S(s)
| ||
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80mL蒸馏水. 另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中.
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60分钟.
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤、洗涤、低温干燥,得到产品.
回答问题:

(1)Na2S2O3 中硫元素的化合价为___;Na2S2O3在强酸性溶液中不能稳定存在,其原因为___(用离子方程式表示).
(2)仪器a的名称是___,其作用是___
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是___. 检验其是否存在的方法是___.
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0mol•L-1碘的标准溶液滴定(反应原理为:2S2O32-+I2═S4O62-+2I-).
(4)滴定至终点时,溶液颜色的变化:___.
(5)滴定结束后消耗碘的标准溶液体积为20.00mL.产品的纯度为(用含W的代数式表示)___.
▼优质解答
答案和解析
I (1)Na2S2O3 中钠元素化合价为+1加,氧元素化合价为-2价,化合物中化合价代数和为0,则硫元素的化合价为+2价;Na2S2O3在强酸性溶液中生成硫单质和二氧化硫,发生的反应为:S2O32-+2H+=S↓+SO2↑+2H2O;
故答案为:+2;S2O32-+2H+=S↓+SO2↑+2H2O;
(2)仪器a为:冷凝管,作用是冷凝回流乙醇;
故答案为:冷凝管;冷凝回流乙醇;
(3 )S2O32‾具有还原性,能够被氧气氧化成硫酸根离子,所以可能存在的杂质是硫酸钠;检验硫酸钠的方法为:取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4;
故答案为:Na2SO4;取少量产品溶于过量稀盐酸,过滤,向滤液中滴加BaCl2溶液,若产生白色沉淀说明产品中含有Na2SO4;
II (4)滴定结束后,碘单质使淀粉变蓝,所以滴定终点时溶液颜色变化为:由无色变为蓝色,且半分钟内部褪色;
故答案为:由无色变蓝色,半分钟内不褪色;
(5)2S2O32-+I2═S4O62-+2I-,
2 1
x 0.100 0mol•L-1×20×10-3mL
解x=0.002mol,故Na2S2O3•5H2O的物质的量为0.002mol,质量为:0.002×248g/mol=0.992g,则W g产品的纯度为:
×100%;
故答案为:
×100%.
故答案为:+2;S2O32-+2H+=S↓+SO2↑+2H2O;
(2)仪器a为:冷凝管,作用是冷凝回流乙醇;
故答案为:冷凝管;冷凝回流乙醇;
(3 )S2O32‾具有还原性,能够被氧气氧化成硫酸根离子,所以可能存在的杂质是硫酸钠;检验硫酸钠的方法为:取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4;
故答案为:Na2SO4;取少量产品溶于过量稀盐酸,过滤,向滤液中滴加BaCl2溶液,若产生白色沉淀说明产品中含有Na2SO4;
II (4)滴定结束后,碘单质使淀粉变蓝,所以滴定终点时溶液颜色变化为:由无色变为蓝色,且半分钟内部褪色;
故答案为:由无色变蓝色,半分钟内不褪色;
(5)2S2O32-+I2═S4O62-+2I-,
2 1
x 0.100 0mol•L-1×20×10-3mL
解x=0.002mol,故Na2S2O3•5H2O的物质的量为0.002mol,质量为:0.002×248g/mol=0.992g,则W g产品的纯度为:
| 0.992 |
| W |
故答案为:
| 0.992 |
| W |
看了 Na2S2O3是重要的化工原...的网友还看了以下:
若x、y互为不等于0的相反数,且n是正整数,你认为正确的是()A.xn、yn一定互为相反数B.(1 2020-05-13 …
玻璃工艺品如今做的越来越精美,在玻璃雕刻过程中用到的是氢氟酸,发生的反应为4HF+SiO2=SiF 2020-05-14 …
氰气的化学式为(CN)2,结构式为N≡C-C≡N,性质与卤素相似,下列叙述正确的是()A.在一定条 2020-05-14 …
词类转换(按考试说明字母顺序)1.able-(n.)(反)(反形)2.absent-(n.)3.a 2020-05-17 …
氰气分子式为(CN)2,结构式为N≡C-C≡N,性质与卤素相近.下列叙述不正确的是()A.在一定条 2020-07-23 …
(2014•衡阳)相同质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(M、N在生成物中均 2020-08-03 …
下列说法不正确的是()A.不是所有的共价键(σ键)都具有方向性B.N≡N键能比N=N与N-N的键能和 2020-12-23 …
如图是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是()A 2020-12-24 …
如图1,在平面直角坐标系中,A(m,0),B(0,n),反比例函数y=kx(x>0)的图象经过点P( 2020-12-25 …
如果有理数m,n满足|m|-n=0,那么m,n的关系是()A.互为相反数B.m=±n且n≥0C.相等 2021-02-02 …