早教吧作业答案频道 -->化学-->
某化学实验小组探究镁与氯化铵溶液反应的气体产物和剧烈反应的影响因素.资料:①CH3COONH4溶液是中性的.②1mol/LNH4Cl溶液的pH=4.63,可以溶解Mg(OH)2沉淀.探究一:镁与氯化铵溶液反应
题目详情
某化学实验小组探究镁与氯化铵溶液反应的气体产物和剧烈反应的影响因素.
资料:①CH3COONH4溶液是中性的.
②1mol/L NH4Cl 溶液的pH=4.63,可以溶解Mg(OH)2沉淀.
探究一:镁与氯化铵溶液反应的气体产物
【实验1】(图1)
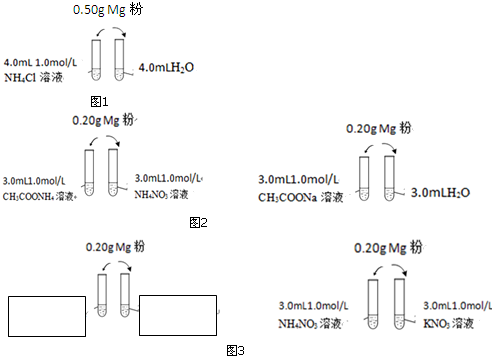
探究二:镁与氯化铵溶液剧烈反应的原因
设想1:镁与氯化铵水解产生的H+反应生成氢气
【实验2-1】【实验2-2】(图2)
设想2:Cl-的影响设想3:NH4+的影响
【实验3】【实验4】(图3)
(1)实验1在左边试管出气管口用湿润的红色石蕊试纸检验试管口产生的气体,试纸变蓝,说明有___生成;用排水法收集一小试管产生的气体,靠近酒精灯,点燃,可以听到爆鸣声,说明有___生成.
(2)写出实验1右边试管Mg与水反应的化学方程式___.
(3)实验2-1中两试管反应都很剧烈,说明NH4NO3水解产生的H+对反应影响___(填“小”或“大”),NH4+对反应影响___(填“小”或“大”).
(4)实验2-2的两支试管中实验现象相同,其设计目的是___.
(5)实验3中的实验现象说明Cl-对反应速率的影响很小,请在空白处补充完成实验方案设计.
(6)实验4中的结论说明NH4+对反应速率的影响很大,则两支试管中实验现象的不同之处是___.
(7)通过实验1至实验4的探究,得出的结论是___.
(8)写出镁与氯化铵溶液反应生成Mg2+的离子方程式___.
资料:①CH3COONH4溶液是中性的.
②1mol/L NH4Cl 溶液的pH=4.63,可以溶解Mg(OH)2沉淀.
探究一:镁与氯化铵溶液反应的气体产物
【实验1】(图1)

探究二:镁与氯化铵溶液剧烈反应的原因
设想1:镁与氯化铵水解产生的H+反应生成氢气
【实验2-1】【实验2-2】(图2)
设想2:Cl-的影响设想3:NH4+的影响
【实验3】【实验4】(图3)
(1)实验1在左边试管出气管口用湿润的红色石蕊试纸检验试管口产生的气体,试纸变蓝,说明有___生成;用排水法收集一小试管产生的气体,靠近酒精灯,点燃,可以听到爆鸣声,说明有___生成.
(2)写出实验1右边试管Mg与水反应的化学方程式___.
(3)实验2-1中两试管反应都很剧烈,说明NH4NO3水解产生的H+对反应影响___(填“小”或“大”),NH4+对反应影响___(填“小”或“大”).
(4)实验2-2的两支试管中实验现象相同,其设计目的是___.
(5)实验3中的实验现象说明Cl-对反应速率的影响很小,请在空白处补充完成实验方案设计.
(6)实验4中的结论说明NH4+对反应速率的影响很大,则两支试管中实验现象的不同之处是___.
(7)通过实验1至实验4的探究,得出的结论是___.
(8)写出镁与氯化铵溶液反应生成Mg2+的离子方程式___.
▼优质解答
答案和解析
(1)实验1在左边试管出气管口用湿润的红色石蕊试纸检验试管口产生的气体,试纸变蓝,说明有氨气生成,用排水法收集一小试管产生的气体,靠近酒精灯,点燃,可以听到爆鸣声,说明有氢气生成,
故答案为:氨气;氢气;
(2)镁是活泼金属与水反应生成氢氧化镁和氢气,实验1右边试管Mg与水反应的化学方程式为:Mg+2H2O=Mg(OH)2↓+H2↑,
故答案为:Mg+2H2O=Mg(OH)2↓+H2↑;
(3)硝酸铵水解显酸性,醋酸铵溶液中醋酸根离子水解和铵根离子水解程度相同,溶液呈中性,实验2-1中两试管反应都很剧烈,说明NH4NO3水解产生的H+对反应影响小,NH4+对反应影响大,
故答案为:小;大;
(4)醋酸钠溶液中醋酸根离子水解显碱性,镁和醋酸钠不反应,镁是溶液中水发生的反应与水中镁发生的反应程度相同,说明醋酸根不影响反应速率,实验2-2的两支试管中实验现象相同,其设计目的是为了排除CH3COO-的影响,
故答案为:为了排除CH3COO-的影响;
(5)实验现象说明Cl-对反应速率的影响很小,试管中的溶液应为同浓度的氯化钠溶液和硝酸钠溶液中反应程度相同,溶液体积和浓度依据上述实验确定,浓度为1.0mol/L,体积为3.0ml,则左边试管中为3.0 mL 1.0 mol/LNaCl溶液;右边试管中为:3.0 mL 1.0 mol/LNaNO3溶液,
故答案为:3.0 mL 1.0 mol/LNaCl溶液;3.0 mL 1.0 mol/LNaNO3溶液;
(6)实验4中的结论说明NH4+对反应速率的影响很大,证明铵根离子对镁反应影响程度大,反应剧烈,硝酸钾溶液中反应程度小,实验4中的结论说明NH4+对反应速率的影响很大,则两支试管中实验现象的不同之处是:NH4NO3溶液(左试管)和KNO3溶液(右试管)分别与Mg粉反应,左试管反应剧烈,有大量气泡生成,右试管反应很少,没有气泡生成,
故答案为:NH4NO3溶液(左试管)和KNO3溶液(右试管)分别与Mg粉反应,左试管反应剧烈,有大量气泡生成,右试管反应很少,没有气泡生成;
(7)上述实验分析可知,通过实验1至实验4的探究,得出的结论是:镁和氯化铵溶液产生的气体不全是氢气,还有氨气;并不是镁与氯化铵水解产生的H+反应生成氢气;H2O和NH4+都是氧化剂,起氧化作用,Cl-不起明显的作用,
故答案为:镁和氯化铵溶液产生的气体不全是氢气,还有氨气;并不是镁与氯化铵水解产生的H+反应生成氢气;H2O和NH4+都是氧化剂,起氧化作用,Cl-不起明显的作用;
(8)镁与氯化铵溶液反应生成Mg2+和氨气、氢气,反应的离子方程式为:Mg+2NH4+=Mg2++2NH3↑+H2↑,
故答案为:Mg+2NH4+=Mg2++2NH3↑+H2↑.
故答案为:氨气;氢气;
(2)镁是活泼金属与水反应生成氢氧化镁和氢气,实验1右边试管Mg与水反应的化学方程式为:Mg+2H2O=Mg(OH)2↓+H2↑,
故答案为:Mg+2H2O=Mg(OH)2↓+H2↑;
(3)硝酸铵水解显酸性,醋酸铵溶液中醋酸根离子水解和铵根离子水解程度相同,溶液呈中性,实验2-1中两试管反应都很剧烈,说明NH4NO3水解产生的H+对反应影响小,NH4+对反应影响大,
故答案为:小;大;
(4)醋酸钠溶液中醋酸根离子水解显碱性,镁和醋酸钠不反应,镁是溶液中水发生的反应与水中镁发生的反应程度相同,说明醋酸根不影响反应速率,实验2-2的两支试管中实验现象相同,其设计目的是为了排除CH3COO-的影响,
故答案为:为了排除CH3COO-的影响;
(5)实验现象说明Cl-对反应速率的影响很小,试管中的溶液应为同浓度的氯化钠溶液和硝酸钠溶液中反应程度相同,溶液体积和浓度依据上述实验确定,浓度为1.0mol/L,体积为3.0ml,则左边试管中为3.0 mL 1.0 mol/LNaCl溶液;右边试管中为:3.0 mL 1.0 mol/LNaNO3溶液,
故答案为:3.0 mL 1.0 mol/LNaCl溶液;3.0 mL 1.0 mol/LNaNO3溶液;
(6)实验4中的结论说明NH4+对反应速率的影响很大,证明铵根离子对镁反应影响程度大,反应剧烈,硝酸钾溶液中反应程度小,实验4中的结论说明NH4+对反应速率的影响很大,则两支试管中实验现象的不同之处是:NH4NO3溶液(左试管)和KNO3溶液(右试管)分别与Mg粉反应,左试管反应剧烈,有大量气泡生成,右试管反应很少,没有气泡生成,
故答案为:NH4NO3溶液(左试管)和KNO3溶液(右试管)分别与Mg粉反应,左试管反应剧烈,有大量气泡生成,右试管反应很少,没有气泡生成;
(7)上述实验分析可知,通过实验1至实验4的探究,得出的结论是:镁和氯化铵溶液产生的气体不全是氢气,还有氨气;并不是镁与氯化铵水解产生的H+反应生成氢气;H2O和NH4+都是氧化剂,起氧化作用,Cl-不起明显的作用,
故答案为:镁和氯化铵溶液产生的气体不全是氢气,还有氨气;并不是镁与氯化铵水解产生的H+反应生成氢气;H2O和NH4+都是氧化剂,起氧化作用,Cl-不起明显的作用;
(8)镁与氯化铵溶液反应生成Mg2+和氨气、氢气,反应的离子方程式为:Mg+2NH4+=Mg2++2NH3↑+H2↑,
故答案为:Mg+2NH4+=Mg2++2NH3↑+H2↑.
看了 某化学实验小组探究镁与氯化铵...的网友还看了以下:
将5.1g镁铝合金溶于300ml2mol/l的盐酸中、完全溶解后滴入3mol/l的nao将5.1g 2020-05-16 …
将一定量Mg、Al合金溶于1mol•L-1的HCl溶液中,然后向所得溶液中滴加1mol•L-1的N 2020-06-12 …
将一定量Mg、Al合金溶于1mol•L-1的HCl溶液中,然后向所得溶液中滴加1mol•L-1的N 2020-06-12 …
将镁、铝的混合物共0.2mol,溶于200mL4mol•L-1的盐酸溶液中,然后再滴加2mol•L 2020-06-17 …
将Xg镁和Yg铝溶于AmLMmol/L的盐酸(过量),再往上述溶液中加入2AmL的NaOH溶液,溶 2020-06-17 …
下列各对溶液用半透膜隔开水分子的渗透方向0.2mol•L-1KCl和0.2mol·L-1蔗糖溶液0 2020-07-08 …
甲酸是一种一元有机酸.下列性质可以证明它是弱电解质的是()A.甲酸能与水以任意比互溶B.1mol• 2020-07-24 …
如表是生长素类似物萘乙酸溶液对某植物插条生根影响的实验处理结果,有关该实验的说法错误的是()A组B 2020-07-25 …
某同学在实验里欲配置6mol/L的H2SO4溶液,现有三种不同浓度的H2SO4溶液①240ml1mo 2021-01-22 …
常温下,有下列水溶液:①pH=0的盐酸②0.5mol•L-1的盐酸③0.1mol•L-1的NH4Cl 2021-02-01 …