早教吧作业答案频道 -->化学-->
某化学课外小组设计了如下图所示的装置,进行氨气性质实验.利用图1完成氨的催化氧化实验,其中箭头表示气体流向,A、B表示两种纯净、干燥的气体,反应进行一段时间后,装置已
题目详情
某化学课外小组设计了如下图所示的装置,进行氨气性质实验.利用图1完成氨的催化氧化实验,其中箭头表示气体流向,A、B表示两种纯净、干燥的气体,反应进行一段时间后,装置已中有红棕色气体生成.实验中所用的药品和干燥剂只能从下列物质中选取KMnO 4 、Na 2 O 2 、NH 4 Cl、NH 4 HCO 3 、P 2 O 5 、碱石灰、生石灰、蒸馏水、浓硫酸、浓氨水
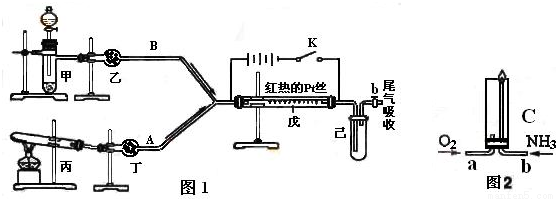
根据图1中装置和反应现象请回答:
(1)若乙中盛有P 2 O 5 ,此时丙装置中发生反应的化学方程式为______ NH 3 ↑+CO 2 ↑+H 2 O

根据图1中装置和反应现象请回答:
(1)若乙中盛有P 2 O 5 ,此时丙装置中发生反应的化学方程式为______ NH 3 ↑+CO 2 ↑+H 2 O
▼优质解答
答案和解析
分析:
(1)如果乙中是五氧化二磷,则甲中产生的气体是氧气,丙中产生的气体是氨气,根据反应物的状态选取反应物;如果丁中盛有P2O5,则丙中产生的气体是氧气,甲中产生的气体是氨气,根据反应物的状态及反应条件选取反应物;(2)利用气体的压强差检验装置的气密性;(3)二氧化氮和四氧化二氮之间的反应是可逆的放热反应,降低温度,平衡向放热反应方向移动,二氧化氮和水反应生成硝酸和一氧化氮,二氧化氮是红棕色气体,一氧化氮是无色气体,根据二氧化氮、一氧化氮的颜色及氧气的压强变化分析;(4)氨气在空气中不能点燃且有刺激性气味,污染大气;(5)液氨和水类似,也能发生电离:NH3+NH3=NH4++NH2-,钠和液氨反应方程式为:2Na+2NH3=2NaNH2+H2↑,据此判断反应方向,结合化学方程式计算.
(1)如果乙中是五氧化二磷,则甲中产生的气体是氧气,丙中产生的气体是氨气,根据反应物的状态知,反应物是碳酸氢铵,在加热条件下,碳酸氢铵分解生成氨气、水和二氧化碳,反应方程式为:NH4HCO3NH3↑+CO2↑+H2O;如果丁中盛有P2O5,则丙中产生的气体是氧气,甲中产生的气体是氨气,根据反应物的状态及反应条件知,反应物是浓氨水和生石灰(或碱石灰),故答案为:NH4HCO3NH3↑+CO2↑+H2O;浓氨水和生石灰(或碱石灰);(2)利用气体的压强差检验装置的气密性,检验方法是:关闭分液漏斗的活塞,将试管中的导管口浸没在水槽中的液面以下,双手紧贴试管外壁,导管口有气泡冒出,松开手后,导管内形成一段水柱,证明装置的气密性良好,故答案为:关闭分液漏斗的活塞,将试管中的导管口浸没在水槽中的液面以下,双手紧贴试管外壁,导管口有气泡冒出,松开手后,导管内形成一段水柱,证明装置的气密性良好;(3)二氧化氮和四氧化二氮之间的反应是可逆的放热反应,降低温度,平衡向正反应方向移动,则二氧化氮浓度减小,所以气体颜色变浅;二氧化氮和水反应生成硝酸和一氧化氮,一氧化氮是无色气体,二氧化氮是红棕色气体,二氧化氮和水反应后气体压强减小,外界大气压不变,所以外界大气压对水作用而使水进入试管中,故答案为:气体颜色变浅;2NO2?N2O4,正反应属于放热反应,达到平衡后,降低温度,平衡向右移动,NO2浓度减小,所以气体颜色变浅;红棕色气体变为无色,试管内液面上升;(4)氨气有刺激性气味,对大气有污染,且氨气在空气中不能点燃,所以应先通入O2,后通过NH3,故答案为:氨气在空气中不能点燃,逸出造成污染;(5)将2.3g金属钠投入1.0L液氨中发生反应为:2Na+2NH3=2NaNH2+H2↑,所以促进液氨的电离,依据:NH3+NH3=NH4++NH2-,[NH4+][NH2-]=l.0×l0-30,反应生成NH2-物质的量为0.1mol,浓度为0.1mol/L,所得溶液中NH4+的浓度l.0×l0-29mol/L,所以pNH4+=29,故答案为:正方向;29.
点评:
本题考查了气体的制取和干燥、外界条件对化学平衡的影响、弱电解质的电离等知识点,会根据氧气、氨气的制取原理、化学平衡移动原理、水的电离平衡原理来大小解答,利用知识迁移的方法分析液氨和钠的反应,难度中等.
分析:
(1)如果乙中是五氧化二磷,则甲中产生的气体是氧气,丙中产生的气体是氨气,根据反应物的状态选取反应物;如果丁中盛有P2O5,则丙中产生的气体是氧气,甲中产生的气体是氨气,根据反应物的状态及反应条件选取反应物;(2)利用气体的压强差检验装置的气密性;(3)二氧化氮和四氧化二氮之间的反应是可逆的放热反应,降低温度,平衡向放热反应方向移动,二氧化氮和水反应生成硝酸和一氧化氮,二氧化氮是红棕色气体,一氧化氮是无色气体,根据二氧化氮、一氧化氮的颜色及氧气的压强变化分析;(4)氨气在空气中不能点燃且有刺激性气味,污染大气;(5)液氨和水类似,也能发生电离:NH3+NH3=NH4++NH2-,钠和液氨反应方程式为:2Na+2NH3=2NaNH2+H2↑,据此判断反应方向,结合化学方程式计算.
(1)如果乙中是五氧化二磷,则甲中产生的气体是氧气,丙中产生的气体是氨气,根据反应物的状态知,反应物是碳酸氢铵,在加热条件下,碳酸氢铵分解生成氨气、水和二氧化碳,反应方程式为:NH4HCO3NH3↑+CO2↑+H2O;如果丁中盛有P2O5,则丙中产生的气体是氧气,甲中产生的气体是氨气,根据反应物的状态及反应条件知,反应物是浓氨水和生石灰(或碱石灰),故答案为:NH4HCO3NH3↑+CO2↑+H2O;浓氨水和生石灰(或碱石灰);(2)利用气体的压强差检验装置的气密性,检验方法是:关闭分液漏斗的活塞,将试管中的导管口浸没在水槽中的液面以下,双手紧贴试管外壁,导管口有气泡冒出,松开手后,导管内形成一段水柱,证明装置的气密性良好,故答案为:关闭分液漏斗的活塞,将试管中的导管口浸没在水槽中的液面以下,双手紧贴试管外壁,导管口有气泡冒出,松开手后,导管内形成一段水柱,证明装置的气密性良好;(3)二氧化氮和四氧化二氮之间的反应是可逆的放热反应,降低温度,平衡向正反应方向移动,则二氧化氮浓度减小,所以气体颜色变浅;二氧化氮和水反应生成硝酸和一氧化氮,一氧化氮是无色气体,二氧化氮是红棕色气体,二氧化氮和水反应后气体压强减小,外界大气压不变,所以外界大气压对水作用而使水进入试管中,故答案为:气体颜色变浅;2NO2?N2O4,正反应属于放热反应,达到平衡后,降低温度,平衡向右移动,NO2浓度减小,所以气体颜色变浅;红棕色气体变为无色,试管内液面上升;(4)氨气有刺激性气味,对大气有污染,且氨气在空气中不能点燃,所以应先通入O2,后通过NH3,故答案为:氨气在空气中不能点燃,逸出造成污染;(5)将2.3g金属钠投入1.0L液氨中发生反应为:2Na+2NH3=2NaNH2+H2↑,所以促进液氨的电离,依据:NH3+NH3=NH4++NH2-,[NH4+][NH2-]=l.0×l0-30,反应生成NH2-物质的量为0.1mol,浓度为0.1mol/L,所得溶液中NH4+的浓度l.0×l0-29mol/L,所以pNH4+=29,故答案为:正方向;29.
点评:
本题考查了气体的制取和干燥、外界条件对化学平衡的影响、弱电解质的电离等知识点,会根据氧气、氨气的制取原理、化学平衡移动原理、水的电离平衡原理来大小解答,利用知识迁移的方法分析液氨和钠的反应,难度中等.
看了 某化学课外小组设计了如下图所...的网友还看了以下:
某实验小组在实验室里设计了如图装置用来制取合成氨基甲酸铵的原料气体-干燥的氨气和二氧化碳.①若用图 2020-05-12 …
如图是实验室制氨气的装置图,请回答:①写出实验室制取氨气的化学反应方程式:②收集氨气用法,③干燥氨 2020-05-14 …
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2 2020-06-10 …
某实验小组在实验室制备氨气并进行氨的催化氧化实验,实验装置如图1:完成下列填空:(1)写出上述制备 2020-06-24 …
某实验小组设计如下装置探究氨气的性质:(1)制备氨气:用装置A制取纯净、干燥的氨气,大试管内碳酸盐 2020-07-22 …
图1是某课外小组设计在实验室制取氨气的装置图,请依据要求,回答下列问题.(1)写出带标号的仪器的名称 2020-10-30 …
某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答下列问题:(1)实 2021-01-22 …
综合考虑下表中几种金属的物理特性及市场价格,选用做学生实验用组导线比较适宜(选填金属名称):高压输电 2021-01-22 …
综合考虑下表中几种金属的物理特性及市场价格,选用做学生实验用组导线比较适宜(选填金属名称):高压输电 2021-01-22 …
氨气是重要的化工原料.实验室可用浓氨水和来制取氨气.a.烧碱b.生石灰c.氯化铵(2)某实验小组设计 2021-02-01 …