早教吧作业答案频道 -->化学-->
开发新能源是解决环境污染的重要举措,工业常用CH4与CO2反应制备H2和CO,再H2和CO利用合成甲醇.(1)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1274.0KJ/mol②2CO(g)+O2(g)═2CO2(g
题目详情
开发新能源是解决环境污染的重要举措,工业常用CH4与CO2反应制备H2和CO,再H2和CO利用合成甲醇.
(1)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1274.0KJ/mol
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0KJ/mol
③H2O(g)═H2O(l)△H3=-44KJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___.
(2)在恒容密闭容器中通入CH4与CO2,使其物质的量浓度为1.0mol/L,在一定条件下发生反应:CO2(g)+CH4(g)⇌2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示:

则:①该反应的△H___0(填“<、=或>”);
②压强P1、P2、P3、P4由大到小的关系为___.压强为P4时,在b点:v(正)___v(逆).(填“<、=或>”)
③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp=___;如果P4=0.36MPa,求a点的平衡常数Kp=___;(保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制出了2条速率-浓度 关系曲线:v正~c(CH4)和v逆~c(CO).
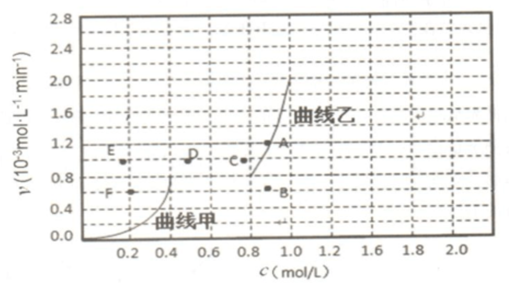
则:ⅰ)与曲线v正~c(CH4)相对应的是上图中曲线___(填“甲”或“乙”).
ⅱ)当降低到某一温度时,反应重新达到平衡,相应的平衡点分别为___(填字母).
(1)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1274.0KJ/mol
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0KJ/mol
③H2O(g)═H2O(l)△H3=-44KJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___.
(2)在恒容密闭容器中通入CH4与CO2,使其物质的量浓度为1.0mol/L,在一定条件下发生反应:CO2(g)+CH4(g)⇌2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示:

则:①该反应的△H___0(填“<、=或>”);
②压强P1、P2、P3、P4由大到小的关系为___.压强为P4时,在b点:v(正)___v(逆).(填“<、=或>”)
③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp=___;如果P4=0.36MPa,求a点的平衡常数Kp=___;(保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制出了2条速率-浓度 关系曲线:v正~c(CH4)和v逆~c(CO).

则:ⅰ)与曲线v正~c(CH4)相对应的是上图中曲线___(填“甲”或“乙”).
ⅱ)当降低到某一温度时,反应重新达到平衡,相应的平衡点分别为___(填字母).
▼优质解答
答案和解析
(1)根据盖斯定律,将已知反应[①-②-③×4]÷2得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H=[(-1274.0kJ/mol)-(-566.0kJ/mol)-(-44.0kJ/mol)×4]÷2=442kJ•mol-1,即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442kJ•mol-1;
(2)①由图可知,压强一定时,温度越高甲烷的转化率越大,升高温度平衡向正反应进行,故正反应为吸热反应,即△H>0,
故答案为:>;
②由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1,由图可知,压强为P4、1100℃的条件下,到达平衡X点时甲烷的转化率为80%,Y点甲烷的转化率小于80%,反应向正反应进行,故在Y点:v(正)>v(逆),
故答案为:p4>p3>p2>p1;>;
③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp=
,
结合化学平衡三段式列式计算,设体积为1L,a点甲烷转化率为80%,
CO2(g)+CH4(g)⇌2CO(g)+2H2(g),
起始量(mol) 0.1 0.1 0 0
变化量(mol)0.08 0.08 0.16 0.16
平衡量(mol)0.02 0.02 0.16 0.16
平衡气体总物质的量=0.36mol,如果P4=0.36MPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,求a点的平衡常数Kp=
=1.64(MPa)2,
故答案为:
;1.64(MPa)2;
④i)甲烷是反应物随反应进行浓度减小,CO是生成物,浓度从0到0.8,所以与曲线v正~c(CH4)相对应的是上图中曲线是乙,
故答案为:乙;
ii)反应是吸热反应,降温平衡逆向进行,CO逆反应速率减小,正反应速率减小,甲烷浓度增大,一氧化碳浓度减小,反应重新达到平衡,相应的平衡点分别为BF,
故答案为:B F.
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442kJ•mol-1;
(2)①由图可知,压强一定时,温度越高甲烷的转化率越大,升高温度平衡向正反应进行,故正反应为吸热反应,即△H>0,
故答案为:>;
②由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1,由图可知,压强为P4、1100℃的条件下,到达平衡X点时甲烷的转化率为80%,Y点甲烷的转化率小于80%,反应向正反应进行,故在Y点:v(正)>v(逆),
故答案为:p4>p3>p2>p1;>;
③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp=
| P2(CO)P2(H2) |
| P(CO2)P(CH4) |
结合化学平衡三段式列式计算,设体积为1L,a点甲烷转化率为80%,
CO2(g)+CH4(g)⇌2CO(g)+2H2(g),
起始量(mol) 0.1 0.1 0 0
变化量(mol)0.08 0.08 0.16 0.16
平衡量(mol)0.02 0.02 0.16 0.16
平衡气体总物质的量=0.36mol,如果P4=0.36MPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,求a点的平衡常数Kp=
(0.36×
| ||||
0.36×
|
故答案为:
| P2(CO)P2(H2) |
| P(CO2)P(CH4) |
④i)甲烷是反应物随反应进行浓度减小,CO是生成物,浓度从0到0.8,所以与曲线v正~c(CH4)相对应的是上图中曲线是乙,
故答案为:乙;
ii)反应是吸热反应,降温平衡逆向进行,CO逆反应速率减小,正反应速率减小,甲烷浓度增大,一氧化碳浓度减小,反应重新达到平衡,相应的平衡点分别为BF,
故答案为:B F.
看了 开发新能源是解决环境污染的重...的网友还看了以下:
为了保护环境,池州海螺集团决定购买10台污水处理设备,现有H和G两种型号设备,其中每台价格及月处理 2020-05-16 …
设函数f,g,h∈r的r次方,且有f(x)=x+3,g(x)=2x+1,h(x)=x/2,求f°g 2020-06-12 …
阅读下列算法,指出算法A的功能和时间复杂度,其中h、g分别为单循环链表中两个节点指针.voidB( 2020-06-12 …
H和K是群G的正规子群,且HK=G.证:G/(H∩K)是到(G/H)×(G/K)的同构.我的思路是 2020-07-09 …
一个9位数abcdefghi满足:1.a+b+...+h+i=cd2.a(b+d-c)=243.( 2020-07-19 …
利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,其能源和环境 2020-07-21 …
导数乘法证明中h是什么意思?(f(x)g(x))'=lim(h→0)[f(x+h)g(x+h)-f 2020-07-22 …
设函数f,g,h∈R,且有f(x)=x+3,g(x)=2x+1,h(x)=x/2,求出f○g,g○ 2020-07-26 …
推断题:现有如下反应(反应条件均不给),推断物质⑴A→B+C+D⑵C+E→C+F+D⑶D+G→H⑷ 2020-07-30 …
设f(x),g(x),h(x)是R上的任意实数函数,如下定义两个函数和(f·g)(x);对任意x∈R 2020-12-22 …