早教吧作业答案频道 -->化学-->
利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,其能源和环境上的双重意义重大.该技术中的化学反应为:CH4(g)+3CO2(g)⇌2H2O(g)+4CO(g)△H&g
题目详情
利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,其能源和环境上的双重意义重大.该技术中的化学反应为:CH4(g)+3CO2(g)⇌2H2O(g)+4CO(g)△H>0
CH4超干重整CO2的催化转化原理示意如图2:
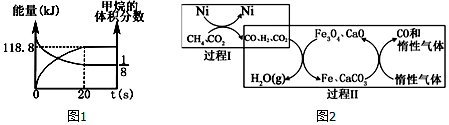
(4)过程Ⅱ,实现了含氢物种与含碳物种的分离.生成H2O(g)的化学方程式是___.
(5)假设过程I和过程Ⅱ中的各步均转化完全,下列说法正确的是___.((填序号)
a.过程Ⅰ和过程Ⅱ中均含有氧化还原反应
b.过程Ⅱ中使用的催化剂为Fe3O4 和CaCO3
c.若过程I投料
=1,可导致过程Ⅱ中催化剂失效
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2mol CH4(g)和4.8mol CO2(g),发生反应CH4(g)+3CO2(g)⇌2H2O(g)+4CO(g)△H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图象如图1.计算该条件下,此反应的△H=___.
CH4超干重整CO2的催化转化原理示意如图2:

(4)过程Ⅱ,实现了含氢物种与含碳物种的分离.生成H2O(g)的化学方程式是___.
(5)假设过程I和过程Ⅱ中的各步均转化完全,下列说法正确的是___.((填序号)
a.过程Ⅰ和过程Ⅱ中均含有氧化还原反应
b.过程Ⅱ中使用的催化剂为Fe3O4 和CaCO3
c.若过程I投料
| n(CH4) |
| n(CO2) |
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2mol CH4(g)和4.8mol CO2(g),发生反应CH4(g)+3CO2(g)⇌2H2O(g)+4CO(g)△H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图象如图1.计算该条件下,此反应的△H=___.
▼优质解答
答案和解析
(4)过程I:CH4+CO2(g)
2H2(g)+2CO,过程Ⅱ:实现了含氢物种与含碳物种的分离,氢气和四氧化三铁反应:4H2+Fe3O4
3Fe+4H2O,
故答案为:4H2+Fe3O4
3Fe+4H2O;
(5)a.过程I:CH4+CO2(g)
2H2(g)+2CO,碳、氢元素化合价发生变化,属于氧化还原反应,过程Ⅱ:4H2+Fe3O4
3Fe+4H2O,氢、铁元素化合价发生变化,属于氧化还原反应,过程I和过程Ⅱ中均含有氧化还原反应,故a正确;
b.过程Ⅱ中使用的Fe3O4 为反应物,不属于催化剂,故b错误;
c.若过程I投料
=1,CH4+CO2(g)
2H2(g)+2CO,催化剂CaO在过程Ⅱ中没有二氧化碳与之反应,催化剂失效,故c正确;
故答案为:a c;
(6)由图可知:20秒时,达到平衡,甲烷的体积分数为
,能量变化为118.8KJ,设变化的甲烷物质的量为x,
CH4(g)+3CO2(g)⇌2H2O(g)+4CO(g)
始(mol ) 1.2 4.8
变(mol ) x 3x 2x 4x
终(mol )1.2-x 4.8-3x 2x 4x
=
,解得x=0.36,0.36mol CH4(g)参加反应能量变化为118.8KJ,则1mol CH4(g)能量变化为330 kJ,则CH4(g)+3CO2(g)⇌2H2O(g)+4CO(g)△H>0,△H=+330 kJ/mol,
故答案为:+330 kJ/mol.
| Ni |
| ||
故答案为:4H2+Fe3O4
| ||
(5)a.过程I:CH4+CO2(g)
| Ni |
| ||
b.过程Ⅱ中使用的Fe3O4 为反应物,不属于催化剂,故b错误;
c.若过程I投料
| n(CH4) |
| n(CO2) |
| Ni |
故答案为:a c;
(6)由图可知:20秒时,达到平衡,甲烷的体积分数为
| 1 |
| 8 |
CH4(g)+3CO2(g)⇌2H2O(g)+4CO(g)
始(mol ) 1.2 4.8
变(mol ) x 3x 2x 4x
终(mol )1.2-x 4.8-3x 2x 4x
| 1.2-x |
| 1.2-x+4.8-3x+2x+4x |
| 1 |
| 8 |
故答案为:+330 kJ/mol.
看了 利用甲烷超干重整CO2技术可...的网友还看了以下:
春秋战国学术思想蓬勃发展的原因正确的用O.错的用X1.贵族没落,沦为平民,使学术流向民间2.政府兴办 2020-03-30 …
CH2=C=O双聚可得B,B是含有一个O原子的四原子环状结构物质B可与C2H5OH,NH3,C6H 2020-04-25 …
选出()部分相同发音的单词()(a)mbassadorA、b(a)sinB、(a)rrivalC、 2020-05-14 …
太平真爱附加手术费补偿医疗保险条款中手术费包含手术材料费、手术麻醉费用、手术用药费用。( )A 2020-05-22 …
在下列各种类型的I/O技术中,对CPU依赖最小的是______。 A.重叠技术B.中断技术C.程序控 2020-05-26 …
椭双(⊙o⊙)双曲线x²/m-y²/n=1(mn≠0)的离心率为2,有一个焦点与椭圆x²/16+y 2020-06-21 …
(2013•云南)下表为某家庭成员部分性状的调查结果,请分析回答:性状家庭成员血型眼睑眼球虹膜的颜 2020-06-23 …
下表为某家庭成员部分性状的调查结果,请分析回管:血型眼睑眼球虹膜的颜色父亲A双眼皮褐色母亲O双眼皮褐 2020-11-24 …
某人用“超级显微镜”观察高真空度o空间,发现了有0对分子A和B环绕0个共同“中心”旋转,从而形成了0 2020-12-16 …
有两双大小、质地相同、仅有颜色不同的拖鞋(分左右脚,可用A1、A2表示一双,用B1、B2表示另一双) 2020-12-25 …