早教吧作业答案频道 -->化学-->
乙醇是生活中常见的物质,用途广泛,其合成方法和性质也具有研究价值.Ⅰ.乙醇可以作为燃料燃烧.已知化学键的键能是指气态原子间形成1mol化学键时释放出的能量.应用表中数据(25
题目详情
乙醇是生活中常见的物质,用途广泛,其合成方法和性质也具有研究价值.
Ⅰ.乙醇可以作为燃料燃烧.
已知化学键的键能是指气态原子间形成1mol化学键时释放出的能量.应用表中数据(25℃、101kPa),写出气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式___.
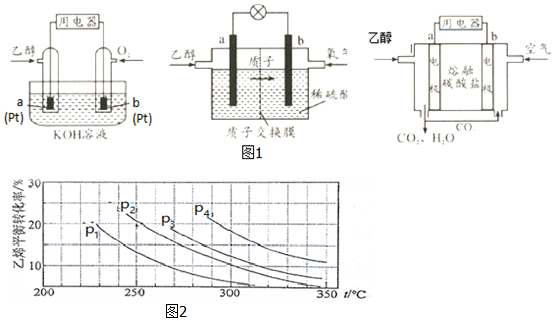
Ⅱ.直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣.现有以下三种乙醇燃料电池(图1).碱性乙醇燃料电池酸性乙醇燃料电池熔融盐乙醇燃料电池
(1)三种乙醇燃料电池中正极反应物均为___.
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为___,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是___.
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为___,通过质子交换膜的离子是___.
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极___(填“a”或“b”)移动,电极b上发生的电极反应式为___.
Ⅲ.已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g)⇌CH3CH2OH(g).当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如图2:
(1)图中压强P1、P2、P3、P4的大小顺序为:___,理由是:___.
(2)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,n(H2O):n(C2H4)=0.6:1.该条件下乙烯的转化率为5%.若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有___、___.
Ⅳ.探究乙醇与溴水是否反应.
(1)探究乙醇与溴水在一定条件下是否可以发生反应,实验如表:
①实验2中向淀粉-KI溶液中滴加冷却后的混合液的目的是___.
②实验3的作用是___.
③根据实验现象得出的结论是___.
(2)探究反应类型
现有含a mol Br2的溴水和足量的乙醇,请从定量的角度设计实验(其他无机试剂任选),探究该反应是取代反应还是氧化反应(已知若发生氧化反应,则Br2全部转化为HBr):___.
Ⅰ.乙醇可以作为燃料燃烧.
已知化学键的键能是指气态原子间形成1mol化学键时释放出的能量.应用表中数据(25℃、101kPa),写出气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式___.
| 键 | C-C | C-H | O=O | H-O | C-O | C=O |
| 键能/(kJ•mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(1)三种乙醇燃料电池中正极反应物均为___.
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为___,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是___.
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为___,通过质子交换膜的离子是___.
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极___(填“a”或“b”)移动,电极b上发生的电极反应式为___.
Ⅲ.已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g)⇌CH3CH2OH(g).当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如图2:
(1)图中压强P1、P2、P3、P4的大小顺序为:___,理由是:___.
(2)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,n(H2O):n(C2H4)=0.6:1.该条件下乙烯的转化率为5%.若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有___、___.
Ⅳ.探究乙醇与溴水是否反应.
(1)探究乙醇与溴水在一定条件下是否可以发生反应,实验如表:
| 实验编号 | 实验步骤 | 实验现象 |
| 1 | 向4mL无水乙醇中加入1mL溴水,充分振荡,静置4小时 | 溶液橙黄色褪去,溶液接近无色 |
| 2 | 向4mL无水乙醇中加入1mL溴水,加热至沸腾 | 开始现象不明显,沸腾后溶液迅速褪色 |
| 向淀粉KI溶液中滴加冷却后的上述混合液 | 溶液颜色不变 | |
| 3 | 向4mL水中加入1mL溴水,加热至沸腾 | 橙黄色略变浅 |
| 向淀粉KI溶液中滴加冷却后的溴水混合液 | 溶液变蓝 |
②实验3的作用是___.
③根据实验现象得出的结论是___.
(2)探究反应类型
现有含a mol Br2的溴水和足量的乙醇,请从定量的角度设计实验(其他无机试剂任选),探究该反应是取代反应还是氧化反应(已知若发生氧化反应,则Br2全部转化为HBr):___.

▼优质解答
答案和解析
Ⅰ反应热=反应物总键能-生成物总键能,则C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H=348kJ/mol+413×5kJ/mol+351kJ/mol+463kJ/mol+498×3kJ/mol-799×2×2kJ/mol-463×2×3kJ/mol=-1253kJ/mol,故答案为:C2H5OH(g)+3O2(g)2CO2(g)+3H2O(g)△H=-1253kJ/mol
Ⅱ(1)正极发生还原反应,三种乙醇燃料电池中正极反应物均为O2,故答案为:O2;
(2)负极上乙醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3CH2OH-12e-+3H2O=2CO2+12H+,空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH,故答案为:CH3CH2OH-12e-+3H2O=2CO2+12H+;空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH;
(3)电池的两极分别充入乙醇和氧气,形成原电池反应时,乙醇被氧化,应为负极;b为正极,正极发生O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;H+;
(4)原电池中阴离子向负极移动,所以CO32-向负极(a)移动,电极b上发生还原反应,故答案为:a;O2+2CO2+4e- 2CO32-;
Ⅲ(1)由图可知,在相同温度下乙烯转化率为p1234,由C2H4(g)+H2O(g)═C2H5OH(g)△H=-45.5kJ•mol-1,可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是p1234,故答案为:p1234;反应分子数减少,相同温度下,压强升高乙烯转化率提高;
(2)若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改变物质的浓度,如从平衡体系中将产物乙醇分离出来,或增大水蒸气的浓度,改变二者物质的量的比等,故答案为:将产物乙醇液化移去;增加nH2O:nC2H4比;
Ⅳ(1)①检验反应后溶液中是否还含有溴单质,故答案为:检验反应后溶液中是否还含有溴单质;
②实验3的作用是对比实验,验证在加热条件下水是否能够与溴单质反应,故答案为:对比实验,验证在加热条件下水是否能够与溴单质反应;
③根据实验现象得出的结论是加热条件下或长期放置,乙醇能够与溴水反应,故答案为:加热条件下或长期放置,乙醇能够与溴水反应;
(2)根据发生氧化反应,则Br2全部转化为HBr,发生取代反应,则Br2一半转化为HBr,取含a mol Br2的溴水和足量的乙醇,混合加热,完全反应后利用AgNO3标准液滴定测定溶液中Br-物质的量.若n(Br-)=a mol则发生取代反应;若n(Br-)=2a mol则发生氧化反应;若a mol-)<2a mol则既发生了取代反应也发生了氧化反应.故答案为:取含a mol Br2的溴水和足量的乙醇,混合加热,完全反应后利用AgNO3标准液滴定测定溶液中Br-物质的量.若n(Br-)=a mol则发生取代反应;若n(Br-)=2a mol则发生氧化反应;若a mol-)<2a mol则既发生了取代反应也发生了氧化反应.
Ⅱ(1)正极发生还原反应,三种乙醇燃料电池中正极反应物均为O2,故答案为:O2;
(2)负极上乙醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3CH2OH-12e-+3H2O=2CO2+12H+,空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH,故答案为:CH3CH2OH-12e-+3H2O=2CO2+12H+;空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH;
(3)电池的两极分别充入乙醇和氧气,形成原电池反应时,乙醇被氧化,应为负极;b为正极,正极发生O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;H+;
(4)原电池中阴离子向负极移动,所以CO32-向负极(a)移动,电极b上发生还原反应,故答案为:a;O2+2CO2+4e- 2CO32-;
Ⅲ(1)由图可知,在相同温度下乙烯转化率为p1
(2)若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改变物质的浓度,如从平衡体系中将产物乙醇分离出来,或增大水蒸气的浓度,改变二者物质的量的比等,故答案为:将产物乙醇液化移去;增加nH2O:nC2H4比;
Ⅳ(1)①检验反应后溶液中是否还含有溴单质,故答案为:检验反应后溶液中是否还含有溴单质;
②实验3的作用是对比实验,验证在加热条件下水是否能够与溴单质反应,故答案为:对比实验,验证在加热条件下水是否能够与溴单质反应;
③根据实验现象得出的结论是加热条件下或长期放置,乙醇能够与溴水反应,故答案为:加热条件下或长期放置,乙醇能够与溴水反应;
(2)根据发生氧化反应,则Br2全部转化为HBr,发生取代反应,则Br2一半转化为HBr,取含a mol Br2的溴水和足量的乙醇,混合加热,完全反应后利用AgNO3标准液滴定测定溶液中Br-物质的量.若n(Br-)=a mol则发生取代反应;若n(Br-)=2a mol则发生氧化反应;若a mol
看了 乙醇是生活中常见的物质,用途...的网友还看了以下:
(1)化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸 2020-03-30 …
以下关于化学键的叙述正确的是A化学键分子内原子间的相互作用B化学键既可以存在于原子之间,也可以存在 2020-06-03 …
工业生产会产生大量CO2,增加了碳排放量.人们一直努力将CO2变废为宝.途径一:将CO2催化加氢可 2020-06-08 …
下列关于化学键的叙述正确的是()A.化学键存在于原子之间,也存在于分子之间B.两个原子之间的相互作 2020-07-13 …
乙苯是一种用途广泛的有机原料,可制备多种化工产品.(一)制备苯乙烯(原理如反应I所示):I.△H= 2020-07-18 …
通常人们把拆开1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键 2020-07-19 …
乙醇是生活中常见的物质,用途广泛,其合成方法和性质也具有研究价值.Ⅰ.乙醇可以作为燃料燃烧.已知化 2020-07-22 …
本题由两部分组成Ⅰ通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量 2020-07-22 …
下列关于化学键的说法正确的是()①原子间的相互作用叫化学键②两个非金属原子间不可能形成离子键③强电 2020-07-29 …
二氧化碳重整甲烷不仅可以获得合成气(CO和H2)还可减少温室气体排放.回答下列问题:(1)已知断裂1 2020-12-30 …