早教吧作业答案频道 -->化学-->
氮肥的使用在提高粮食产量的同时,也导致了土壤、水体污染等环境问题.(1)长期过量使用NH4Cl等铵态化肥,易导致土壤酸化,请用化学用语解释原因.(2)过量的NH4+将导致水体富营
题目详情
氮肥的使用在提高粮食产量的同时,也导致了土壤、水体污染等环境问题.
(1)长期过量使用NH4Cl等铵态化肥,易导致土壤酸化,请用化学用语解释原因___.
(2)过量的NH4+将导致水体富营养化,检测水样中NH4+所需的试剂是___、___.
(3)工业上处理氨氮废水的方法如下:
步骤Ⅰ:采用生物硝化法将NH4+转化NO3-(图1)
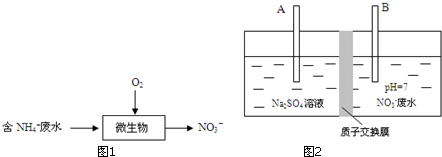
①生物硝化法处理废水,会导致水体pH逐渐下降,用离子方程式解释原因___.
②微生物保持活性的pH范围为7~9,最适宜用来调节水体pH的物质是___.
A.NaOH B.CaCO3 C.NH3•H2O D.CO2
步骤Ⅱ:采用电解法将NO3-转化为N2(图2)
③与电源正极相连的一极是___(填“A”或“B”).
④B极的电极反应是___.
⑤除去1L废水中的62mg NO3-后,废水的pH=___.
(1)长期过量使用NH4Cl等铵态化肥,易导致土壤酸化,请用化学用语解释原因___.
(2)过量的NH4+将导致水体富营养化,检测水样中NH4+所需的试剂是___、___.
(3)工业上处理氨氮废水的方法如下:
步骤Ⅰ:采用生物硝化法将NH4+转化NO3-(图1)

①生物硝化法处理废水,会导致水体pH逐渐下降,用离子方程式解释原因___.
②微生物保持活性的pH范围为7~9,最适宜用来调节水体pH的物质是___.
A.NaOH B.CaCO3 C.NH3•H2O D.CO2
步骤Ⅱ:采用电解法将NO3-转化为N2(图2)
③与电源正极相连的一极是___(填“A”或“B”).
④B极的电极反应是___.
⑤除去1L废水中的62mg NO3-后,废水的pH=___.
▼优质解答
答案和解析
(1)NH4Cl为强酸弱碱盐,水解呈酸性,水解方程式为NH4++H2O⇌NH3•H2O+H+,故答案为:NH4++H2O⇌NH3•H2O+H+;
(2)铵盐与氢氧化钠反应生成氨气,氨气为碱性气体,可加入浓NaOH溶液,然后加入红色石蕊试纸,如变蓝色,说明有氨气生成,
故答案为:浓NaOH溶液;红色石蕊试纸;
(3)①NH4+被氧化生成硝酸根离子和氢离子,反应的离子方程式为NH4++2O2=NO3-+2H++H2O,故答案为:NH4++2O2=NO3-+2H++H2O;
②调节水体pH可加入碱性物质,但不能引入新杂质,应加入碳酸钙,故选B;
③与电源正极相连的一极发生氧化反应,有NO3-的为阴极反应,则A为阳极,故答案为:A;
④B极发生还原反应,NO3-转化为N2,电极方程式为2NO3-+10e-+6H2O=N2+12OH-,故答案为:2NO3-+10e-+6H2O=N2+12OH-;
⑤n(NO3-)=0.001mol,总反应式为4NO3-+2H2O
2N2+5O2+4OH-,可知生成0.001molOH-,c(OH-)=0.001mol/L,pH=11,故答案为:11.
(2)铵盐与氢氧化钠反应生成氨气,氨气为碱性气体,可加入浓NaOH溶液,然后加入红色石蕊试纸,如变蓝色,说明有氨气生成,
故答案为:浓NaOH溶液;红色石蕊试纸;
(3)①NH4+被氧化生成硝酸根离子和氢离子,反应的离子方程式为NH4++2O2=NO3-+2H++H2O,故答案为:NH4++2O2=NO3-+2H++H2O;
②调节水体pH可加入碱性物质,但不能引入新杂质,应加入碳酸钙,故选B;
③与电源正极相连的一极发生氧化反应,有NO3-的为阴极反应,则A为阳极,故答案为:A;
④B极发生还原反应,NO3-转化为N2,电极方程式为2NO3-+10e-+6H2O=N2+12OH-,故答案为:2NO3-+10e-+6H2O=N2+12OH-;
⑤n(NO3-)=0.001mol,总反应式为4NO3-+2H2O
| ||
看了 氮肥的使用在提高粮食产量的同...的网友还看了以下:
下列多音字注音正确的两项是[]A.混:混水摸鱼(h*n)混事魔王(h)n)混为一谈(h(n)混凝土 2020-04-06 …
化简n.(n+1).(n+2).(n+3)+n.n的化简结果 2020-05-14 …
化简n^0+n^1+n^2+n^3+n^4+n^5……+n^n化简完要求能快速算出任意n值对应的式 2020-06-12 …
下列各组词语中加点字的读音,完全正确的一项是()A.抗战(kànɡ)吭气(kēnɡ)土炕(kànɡ 2020-06-28 …
英语翻译为了在激烈的全球竞争中占优势,多数跨国公司在国际营销标准化和本土化的选择问题上,开始采取标准 2020-11-17 …
2005年我国沙土化土地面积为a万平方千米,假设沙土化土地面积每年增长率相同都为x%,那么到2007 2020-11-20 …
英语翻译通过连续7年的定位试验,研究了日光温室生产中不同生产模式施肥对土壤NO3—N时空分布及累积的 2020-11-23 …
在煮过和没煮过的土豆片上分别滴几滴过氧化氢。在土豆片M上出现泡沫,在土豆片N上没有泡沫,以下哪一项是 2020-11-28 …
(09南昌市调研)下图表示植物的光合速率与光照强度的关系,下列叙述正确的是A.从a点开始植物进行光合 2020-12-04 …
解决《粘土化学分析》标准中的问题在GB/T16399-1996《粘土化学分析》标准中,粘土的三氧化硫 2021-01-22 …